Clorhidrato de epirubicina inyectable
DescripciónFunción analítica completa < BR > Laboratorio de recubrimiento de película fina
Clorhidrato de epirubicina inyectable
Indicación
Tratamiento de linfoma maligno, cáncer de mama, cáncer de pulmón, sarcoma de tejidos blandos, cáncer de esófago, cáncer gástrico, cáncer de hígado, cáncer de páncreas, melanoma, cáncer colorrectal, cáncer de ovario, mieloma múltiple, leucemia. La administración intravesical contribuye al tratamiento del cáncer de vejiga superficial, el carcinoma in situ y la prevención de la recurrencia después de la resección transuretral.
Farmacología clínica
La epirubicina es una droga citotóxica antraciclina. Aunque se sabe que las antraciclinas interfieren con muchas funciones bioquímicas y biológicas en las células eucariotas, el mecanismo preciso de citotoxicidad y / o proliferación anti-celular de epirubicina no se ha dilucidado completamente. El anillo plano de epirubicina está incrustado entre los pares de bases para unirse al ADN para formar un complejo, que a su vez inhibe la síntesis de ácidos nucleicos (ADN y ARN) y proteínas. Este proceso de inserción también desencadena la topoisomerasa II para escindir el ADN, produciendo un efecto citocida. La epirubicina también inhibe la actividad de la enzima de escisión del ADN, previene la fusión de doble cadena del ADN inducida por enzimas e interfiere con la replicación y la transcripción. La epirubicina también puede participar en la reacción de oxidación / reducción produciendo radicales libres citotóxicos. La proliferación anti-celular y los efectos citotóxicos de la epirubicina provienen de estos u otros posibles mecanismos de acción. La epirubicina tiene un efecto citotóxico in vitro en una variedad de cultivos primarios establecidos de líneas celulares murinas, humanas y tumores humanos. Al mismo tiempo, también tiene un efecto antitumoral in vivo sobre los xenoinjertos de cáncer humano (incluido el cáncer de mama) en tumores murinos y ratones atímicos.
Uso y dosificación
Dosificación de acuerdo con la enfermedad, siga los consejos del médico. (ver instrucciones para más detalles)
Formulación
Aguja de polvo
Especificación
10mg
Manual de instrucciones
Fecha de aprobación: 16 de agosto de 2012
Fecha de revisión: 1 de diciembre de 2015
Instrucciones de inyección de clorhidrato de epirubicina
Lea atentamente las instrucciones y úselas bajo la guía de un médico.
Advertencia: necrosis tisular, leucemia aguda secundaria y mielosupresión
1. Si se produce extravasación durante la administración, puede causar necrosis tisular local grave. No se administre por vía muscular o subcutánea.
2. La cardiotoxicidad puede ocurrir durante el tratamiento con epirubicina o meses o incluso años después del tratamiento, incluida la insuficiencia cardíaca congestiva mortal (CHF), con una probabilidad clínicamente significativa de CHF de aproximadamente 0.9 a una dosis acumulada de 550 mg / m2. %, 1.6% a una dosis acumulada de 700 mg / m2 y 3.3% a una dosis acumulada de 900 mg / m2. En el ensayo clínico de la terapia adyuvante para el cáncer de mama, la dosis acumulativa máxima fue de 720 mg / m2. El riesgo de CHF aumenta rápidamente cuando la dosis acumulada excede los 900 mg / m2, por lo que se debe tener extrema precaución si excede esta dosis. Cardiopatía activa o inactiva, radioterapia previa o actual con área mediastínica / pericárdica, terapia previa con antraciclinas o esteroides, o mayor riesgo de cardiotoxicidad en pacientes con otros fármacos cardiotóxicos . La cardiotoxicidad de la epirubicina también puede ocurrir a dosis acumulativas más bajas o sin factores de riesgo para el riesgo cardíaco.
3. Se ha informado leucemia mieloide aguda secundaria (AML) en pacientes con cáncer de mama tratados con antraciclinas, incluida la epirubicina. Cuando tales medicamentos se combinan con medicamentos antitumorales que destruyen el ADN, especialmente en pacientes que han recibido medicamentos citotóxicos de alta intensidad o dosis más altas de antraciclinas, se produce leucemia secundaria refractaria. Puede ser más común. La probabilidad de AML relacionada con el tratamiento o síndrome mielodisplásico (SMD) en 7110 pacientes con cáncer de mama que recibieron terapia adyuvante con epirubicina fue 0.27% en 3 años, 0.46% en 5 años y 0.55% en 8 años.
4. Puede haber ocurrido una supresión grave de la médula ósea.
[nombre de la droga]
Nombre genérico: clorhidrato de epirubicina para inyección
Nombre en inglés: Epirubicin Hydrochloride for Injection
Pinyin chino: Zhusheyong Yansuan Biaoroubixing
[ingredientes]
El componente principal de este producto es el clorhidrato de epirubicina.
Nombre químico: (8S, 10S) -10 - [(3-Amino-2,3,6-tridesoxi-α-L-arabinopiranosil) oxi] -6,8,11-trihidroxi-8- (hidroxiacetil) -1-metoxi-7,8,9,10-tetrahidrotetraceno-5,12-diona hidrocloruro
Estructura química:
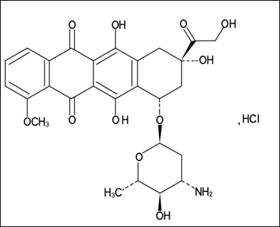
Fórmula molecular: C27H29NO11 · HCl
Peso molecular: 579.98
Excipientes: lactosa, metil paraben.
【Propiedades】 Este producto es una masa o polvo suelto rojo o rojo anaranjado, que es higroscópico.
[indicaciones]
Tratamiento de linfoma maligno, cáncer de mama, cáncer de pulmón, sarcoma de tejidos blandos, cáncer de esófago, cáncer gástrico, cáncer de hígado, cáncer de páncreas, melanoma, cáncer colorrectal, cáncer de ovario, mieloma múltiple, leucemia.
La administración intravesical contribuye al tratamiento del cáncer de vejiga superficial, el carcinoma in situ y la prevención de la recurrencia después de la resección transuretral.
[Especificación] 10mg
[Uso y dosificación]
Dosis de rutina: cuando la epirubicina se administra sola, la dosis para adultos es de 60-120 mg / m2 por área de superficie corporal. Para la inyección intravenosa de 100-120 mg / m2, la dosis inicial total para cada ciclo de tratamiento puede administrarse sola o en dosis divididas durante 2-3 días consecutivos. De acuerdo con la imagen de sangre del paciente, se puede reutilizar con 21 días de diferencia.
Dosis optimizada: se pueden usar dosis altas para tratar el cáncer de pulmón y de mama. Cuando se administra solo, la dosis inicial recomendada para adultos es de hasta 135 mg / m2 por área de superficie corporal, una vez el primer día de cada ciclo de tratamiento o el primer, segundo y tercer día de cada ciclo de tratamiento, 3- Una vez cada 4 semanas. En combinación con la quimioterapia, la dosis inicial recomendada es de hasta 120 mg / m2 según el área de superficie corporal, administrada el primer día de cada ciclo de tratamiento, una vez cada 3-4 semanas. Administrado por vía intravenosa. De acuerdo con la imagen de sangre del paciente, se puede reutilizar con 21 días de diferencia.
Administración intravesical: la epirubicina se perfunde con un catéter y debe permanecer en la vejiga durante aproximadamente una hora. Durante la perfusión, el paciente debe cambiar de posición con frecuencia para garantizar el máximo contacto con el medicamento en la mucosa de la vejiga. Para evitar la dilución inadecuada del medicamento por la orina, se debe recomendar a los pacientes que no beban ningún líquido 12 horas antes de la perfusión. El médico debe indicar al paciente que vacíe la orina al final del tratamiento.
Para el cáncer de vejiga superficial, se disuelve 50 mg de epirubicina en 25 a 50 ml de solución salina normal una vez por semana durante 8 veces. Para casos con toxicidad local (cistitis química), cada dosis puede reducirse a 30 mg. El paciente también recibió 50 mg de la misma dosis del medicamento una vez por semana durante 4 veces, luego 11 veces al mes. El médico puede ajustar la cantidad de dosis según la condición del paciente.
【Reacciones adversas】
1. Similar a la doxorrubicina, pero en menor medida, especialmente cardiotoxicidad y toxicidad mielosupresora;
2, otras reacciones adversas son: pérdida de cabello, pueden ocurrir 60-90% de los casos, generalmente reversible, los hombres tienen una inhibición del crecimiento de la barba, la mucositis, los primeros 5-10 días de medicación, generalmente ocurre en la mucosa lingual y sublingual; Disfunción gastrointestinal, como náuseas, vómitos, diarrea; fiebre ocasional, escalofríos, urticaria, hiperpigmentación, dolor en las articulaciones.
[tabú]
1. Está contraindicado en pacientes que tienen mielosupresión obvia debido a quimioterapia o radioterapia;
2. Los pacientes que han usado grandes dosis de antraciclinas (como doxorrubicina o daunorrubicina) están prohibidos;
3. Pacientes discapacitados con antecedentes recientes o anteriores de daño cardíaco;
4. Instilación intravesical discapacitada en pacientes con hematuria.
【Notas】
1. Sobre la cardiotoxicidad
(1) puede causar daño miocárdico, insuficiencia cardíaca. Las pruebas en animales y los ensayos en humanos a corto plazo han demostrado que la epirubicina es menos cardiotóxica que su isómero, la doxorrubicina. Los estudios comparativos han demostrado que la proporción de epirubicina y doxorrubicina en el mismo grado de disfunción cardíaca es 2: 1. La función cardíaca aún debe ser monitoreada de cerca durante el tratamiento de epirubicina para reducir el riesgo de insuficiencia cardíaca (esta insuficiencia cardíaca puede ocurrir incluso algunas semanas después de la finalización del tratamiento y puede no ser efectiva para el medicamento correspondiente);
(2) El riesgo potencial de cardiotoxicidad por epirubicina puede aumentar en pacientes con radioterapia mediastínica y pericárdica actual o previa;
(3) Se debe tener cuidado cuando se combina con cualquier fármaco potencialmente cardiotóxico para determinar la dosis acumulativa máxima de epirubicina;
(4) Se debe realizar un electrocardiograma antes y después de cada ciclo de tratamiento. Las antraciclinas, especialmente la miocardiopatía inducida por doxorrubicina, exhiben bajo voltaje persistente en el electrocardiograma del complejo QRS, intervalo de contracción prolongado más allá del rango normal (PEP / LVET) y fracción de eyección reducida. Para los pacientes que reciben epirubicina, la monitorización del ECG es muy importante, y la función cardíaca se puede evaluar mediante técnicas no invasivas como la electrocardiografía y la ecocardiografía. La fracción de eyección se puede medir mediante angiografía con radionúclidos si es necesario.
(5) Cuando la dosis acumulativa total de epirubicina supera los 900 mg / m2, la incidencia de insuficiencia cardíaca congestiva progresiva (ICC) aumenta significativamente y el uso de esta dosis acumulativa debe ser muy cuidadoso. Cuando la dosis acumulativa total de epirubicina excede los 900 mg / m2, existe el riesgo de causar cardiomiopatía primaria, y el uso de esta dosis acumulativa debe ser muy cuidadoso. Los factores de riesgo para desarrollar cardiotoxicidad incluyen enfermedad cardiovascular activa o inactiva, radioterapia actual o previa en el mediastino / región periférica, uso previo de otras antraciclinas o antraquinonas, y el uso concurrente de otro miocardio inhibidor Un medicamento sistólico o un medicamento cardiotóxico (como trastuzumab). A menos que se controle de cerca la función cardíaca del paciente, las antraciclinas, incluida la epirubicina, no se pueden usar simultáneamente con otros medicamentos cardiotóxicos. Los pacientes que reciben antraciclinas después de suspender el uso de otros medicamentos cardiotóxicos (especialmente medicamentos con semividas prolongadas como trastuzumab) también pueden aumentar el riesgo de desarrollar cardiotoxicidad. La vida media de trastuzumab es de 28.5 días y puede durar hasta 24 semanas en la circulación sanguínea. Por lo tanto, si es posible, los médicos deben evitar el tratamiento a base de antraciclina dentro de las 24 semanas posteriores a la interrupción de trastuzumab. Si se necesita un antibiótico antraciclina antes del evento. Se debe tener cuidado para detectar la función cardíaca.
2, sobre el impacto de la función hepática y renal
(1) Dado que el sistema hepático excreta epirubicina, la disfunción hepática debe reducirse para evitar la acumulación de intoxicaciones. Pacientes con insuficiencia hepática moderada (bilirrubina 1.4-3mg / 100ml o retención de BSP 9-15%), la dosis debe reducirse en un 50%. Pacientes con insuficiencia hepática grave (bilirrubina mayor de 3 mg / 100 ml o retención de BSP mayor del 15%), la dosis debe reducirse en un 75%;
(2) Los pacientes con insuficiencia renal moderada no necesitan reducir la dosis porque solo una pequeña cantidad del medicamento se excreta a través de los riñones. La epirubicina, como otros medicamentos citotóxicos, causa hiperuricemia debido a la rápida desintegración de las células tumorales. Se debe controlar el nivel de ácido úrico en la sangre, y este fenómeno debe controlarse con medicamentos; además, puede producirse una tinción roja en la orina dentro de 1-2 días de la administración;
3, en la supresión de la médula ósea
Puede causar glóbulos blancos y trombocitopenia, y la monitorización hematológica debe realizarse regularmente.
4, sobre las instrucciones de administración
(1) administración intravenosa, diluida con solución salina o agua para inyección, de modo que la concentración final no supere los 2 mg / ml;
(2) Se recomienda inyectar solución salina normal para verificar la permeabilidad del tubo de infusión y la aguja de inyección está después de la vena, y luego se administra a través del tubo de infusión sin obstrucciones. Para reducir el riesgo de derrame de drogas y asegurar que la vena se enjuague con solución salina después de la administración;
(3) El desbordamiento de las venas durante la inyección de epirubicina puede causar daños graves o incluso necrosis del tejido. Pequeñas inyecciones en las venas o inyecciones repetidas del mismo vaso sanguíneo pueden causar esclerosis venosa. Se recomienda tener una buena infusión de vena central;
(4) Sin inyección intramuscular e intratecal.
5, leucemia secundaria
Se ha informado que los pacientes con antraciclinas (incluida la epirubicina) desarrollan leucemia secundaria con o sin síntomas previos a la leucemia. La leucemia secundaria es más común en las siguientes situaciones: cuando se combina con un medicamento contra el cáncer cuyo mecanismo de acción es destruir la estructura del ADN; o cuando el paciente ha usado previamente medicamentos citotóxicos; o cuando se aumenta la dosis de tratamiento con antraciclina. El período de incubación para tales leucemias es generalmente de 1-3 años.
6. Impacto en el sistema reproductivo.
La epirubicina puede destruir los cromosomas de los espermatozoides, y los pacientes varones sometidos a tratamiento con epirubicina deben adoptar métodos anticonceptivos efectivos. La epirubicina puede causar mujeres premenopáusicas con amenorrea o premenopáusicas.
7, efecto inmunosupresor / aumento de la susceptibilidad a la infección
La inhalación de vacunas vivas o atenuadas vivas para pacientes que reciben medicamentos de quimioterapia, incluida la epirubicina, que produce inmunocompromiso, puede provocar infecciones graves o incluso fatales. Los pacientes que reciben epirubicina deben evitar las vacunas vivas. Las vacunas muertas o inactivadas pueden vacunarse, pero la respuesta inmune a estas vacunas puede reducirse.
[Mujeres embarazadas y mujeres lactantes]
No hay datos definitivos sobre si la epirubicina tiene un efecto adverso sobre la fertilidad humana y si tiene efectos teratogénicos u otros efectos nocivos para el feto. Sin embargo, existen datos experimentales que sugieren que la epirubicina es similar a la mayoría de los fármacos antitumorales y agentes inmunosupresores, y exhibe mutagenicidad y carcinogenicidad en animales bajo condiciones de prueba específicas. Puede reducir la tasa de supervivencia del feto. Por lo tanto, este producto no se recomienda durante el embarazo, y las mujeres lactantes están prohibidas.
[Medicamentos para niños] No existen requisitos especiales para los medicamentos para niños.
[Medicación geriátrica] los pacientes de edad avanzada con disfunción cardíaca deben usarse con precaución o reducirse.
[interacción farmacológica]
1, la epirubicina se puede combinar con otros medicamentos antitumorales, pero se debe reducir la cantidad de epirubicina. No lo use en la misma jeringa cuando se usa en combinación.
2, la epirubicina no se puede mezclar con la inyección de heparina, ya que la naturaleza química de los dos no es compatible, la precipitación ocurrirá a una cierta concentración.
3. La epirubicina se metaboliza principalmente en el hígado. Cualquier medicamento que cause cambios en la función hepática durante el tratamiento afectará el metabolismo, la farmacocinética, la eficacia y / o la toxicidad de la epirubicina.
4. El uso de paclitaxel antes de la administración de epirubicina provoca un aumento en los niveles de epirubicina en sangre de profármacos y metabolitos, en los cuales el metabolito no es activo ni tóxico. Cuando se administró paclitaxel o docetaxel en combinación con epirubicina, no hubo efecto sobre la farmacocinética de epirubicina.
【Sobredosis de drogas】
El límite total de este producto es de 550-800 mg / m2 de superficie corporal. 9411 pacientes tratados con epirubicina, la mayoría de ellos son pacientes con tumores sólidos avanzados. Cuando la dosis acumulada alcanza 550 mg / m2, se produce insuficiencia cardíaca congestiva clínicamente obvia. El paciente tenía aproximadamente el 0,9%; aproximadamente el 1,6% cuando la dosis acumulada alcanzaba los 700 mg / m2; y aproximadamente el 3,3% cuando la dosis acumulada alcanzaba los 900 mg / m2. El uso de epirubicina en el tratamiento adyuvante del cáncer de mama tiene una dosis acumulativa máxima de 720 mg / m2 en ensayos clínicos.
No hay antídoto conocido para la epirubicina. Un paciente masculino de 36 años con linfoma no Hodgkin recibió epirubicina 95 mg / m2 una vez al día durante 5 días consecutivos.Después de 5 días, desarrolló crecimiento de la médula ósea, mucositis de grado 4 y tracto gastrointestinal. Sangrado No se observó cardiotoxicidad aguda. Recibió una recuperación completa después del tratamiento con antibióticos, factores estimulantes de colonias y medicamentos antimicóticos. Una paciente de 63 años con metástasis hepáticas por cáncer de mama recibió una dosis única de epirubicina 320 mg / m2 y fue hospitalizada por hipertermia e insuficiencia orgánica múltiple con acidosis láctica y lactato deshidrogenasa. Murió 24 horas después de tomar epirubicina. Hay otros casos en los que se excede la dosis recomendada, con dosis que varían de 150 a 250 mg / m2. Los eventos adversos observados en estos casos fueron similares a la toxicidad conocida de la epirubicina. La mayoría de los pacientes se recuperan después de brindar una atención de apoyo adecuada.
Si se produce una sobredosis, se debe brindar atención de apoyo (incluida la terapia con antibióticos, transfusión o transfusión de plaquetas, factor estimulante de colonias y monitoreo estrecho) hasta que se restablezca la toxicidad. La CHF retrasada puede ocurrir varios meses después de la administración de antraciclina, y los síntomas de CHF deben observarse continuamente y se debe brindar la atención de apoyo adecuada.
【Farmacología y Toxicología】
Acción farmacológica
La epirubicina es una droga citotóxica antraciclina. Aunque se sabe que las antraciclinas interfieren con muchas funciones bioquímicas y biológicas en las células eucariotas, el mecanismo preciso de citotoxicidad y / o proliferación anti-celular de epirubicina no se ha dilucidado completamente.
El anillo plano de epirubicina está incrustado entre los pares de bases para unirse al ADN para formar un complejo, que a su vez inhibe la síntesis de ácidos nucleicos (ADN y ARN) y proteínas. Este proceso de inserción también desencadena la topoisomerasa II para escindir el ADN, produciendo un efecto citocida. La epirubicina también inhibe la actividad de la enzima de escisión del ADN, previene la fusión de doble cadena del ADN inducida por enzimas e interfiere con la replicación y la transcripción. La epirubicina también puede participar en la reacción de oxidación / reducción produciendo radicales libres citotóxicos. La proliferación anti-celular y los efectos citotóxicos de la epirubicina provienen de estos u otros posibles mecanismos de acción.
La epirubicina tiene un efecto citotóxico in vitro en una variedad de cultivos primarios establecidos de líneas celulares murinas, humanas y tumores humanos. Al mismo tiempo, también tiene efectos antitumorales in vivo en xenoinjertos de ratón humano murino y atímico de ratón, incluido el cáncer de mama.
Investigación toxicológica
Genotoxicidad
Los resultados de la prueba de Ames mostraron que la epirubicina podría causar mutación bacteriana independientemente de la activación metabólica; la prueba de HGPRT se realizó en fibroblastos pulmonares de hámster chino V79, y hubo un efecto mutagénico en ausencia de activación metabólica. No hubo efecto mutagénico en las condiciones de activación; en la prueba de aberración cromosómica de linfocitos humanos, la epirubicina mostró efectos mutagénicos independientemente de la activación metabólica. Experimentos in vivo en aberraciones cromosómicas de médula ósea de ratón, la epirubicina también mostró efectos mutagénicos.
Toxicidad reproductiva
En la prueba de fertilidad en ratas, a las ratas machos se les administró epirubicina diariamente durante 9 semanas, y luego se aparearon con ratas hembras (las ratas hembras se administraron diariamente desde 2 semanas antes del apareamiento y continuaron administrándose hasta el séptimo día de gestación). Las ratas eran infértiles cuando la dosis de ratas de ambos sexos era de 0,3 mg / kg / día (aproximadamente 0,015 veces el área de superficie corporal, aproximadamente 0,015 veces la dosis única máxima recomendada). El grupo de 0.1 mg / kg / día no tuvo efecto sobre el comportamiento de apareamiento o la fertilidad en ratas, pero causó atrofia de los testículos y el epidídimo en ratas macho y disminuyó la producción de esperma. El grupo de 0.1 mg / kg / día también causa la muerte del embrión. El grupo de 0.03 mg / kg / día (en términos de área de superficie corporal, aproximadamente 0.0015 veces la dosis única recomendada para la persona máxima recomendada) aumentó la incidencia de retraso en el desarrollo embrionario. La administración de epirubicina en conejos y perros también causa atrofia de los órganos reproductores masculinos. Una sola inyección intravenosa de epirubicina 20.5, 12 mg / kg en ratones y ratas (aproximadamente 0.5 veces la dosis humana máxima recomendada en términos de superficie corporal) resultó en atrofia testicular. Una dosis única de epirubicina a 16,7 mg / kg resultó en atrofia del útero de la rata.
Carcinogenicidad
No se ha realizado una prueba de rutina a largo plazo en animales para evaluar el posible efecto carcinogénico de la epirubicina, pero las ratas hembras recibieron una inyección intravenosa única de epirubicina 3.6 mg / kg (en términos de superficie corporal, aproximadamente 0.2 veces la dosis humana máxima recomendada) Un año después de la administración, la incidencia de cáncer de mama (principalmente fibroadenomas) se duplica aproximadamente. Las ratas recibieron una inyección intravenosa de epirubicina 0,5 mg / kg cada 3 semanas (aproximadamente 0,025 veces la dosis humana máxima recomendada, en función del área de la superficie corporal) para un total de 10 dosis. Durante el período de observación de 18 meses, las ratas macho fueron subcutáneamente La incidencia de fibromas aumenta. Además, la rata nacida se inyecta por vía subcutánea con epirubicina 0,75 o 1,0 mg / kg / día el primer día o el décimo día después del nacimiento (en términos de superficie corporal humana, aproximadamente 0,015 veces la dosis humana máxima recomendada). Se administraron un total de 8 dosis, y la tasa de incidencia de tumores fue mayor que la del grupo de control durante el período de observación en 24 meses.
[Farmacocinética]
El metabolismo y la excreción en el cuerpo son más rápidos que las estrellas, la semivida plasmática promedio de aproximadamente 40 horas, principalmente en el metabolismo del hígado, excretada por la bilis. Dentro de las 48 horas, el 9-10% de la dosis fue excretada por la orina, y dentro de los 4 días, el 40% de la dosis fue administrada por la bilis, que no pasó la barrera hematoencefálica. Para los pacientes con metástasis hepáticas y función hepática alterada, la concentración del fármaco en plasma se mantiene durante un período de tiempo más largo, por lo que la dosis debe reducirse adecuadamente. La función renal normal tiene poco efecto sobre las propiedades farmacocinéticas de este producto.
[Almacenamiento] sombreado, sellado y almacenado en un lugar fresco (no más de 20 ° C).
[Paquete] vial, tapón de goma de bromobutilo. 1 botella / caja.
[Período de validez] 24 meses
[Normas ejecutivas] "Farmacopea China" Edición 2015 2
[Aprobación No.] Norma Nacional de Drogas H20123260
[Fabricante]
Nombre de la empresa: Shandong New Times Pharmaceutical Co., Ltd.
Dirección: No. 1, carretera de circunvalación exterior norte, condado de Feixian, provincia de Shandong
Código postal: 273400
Número de teléfono: 0539-8336336 (Ventas) 5030608 (Departamento de gestión de calidad)
Número de fax: 0539-5030900
Sitio web: www.LUNAN.com.cn
Línea directa de atención al cliente las 24 horas: 400-0539-310
