Comprimidos de montelukast sódico
DescripciónFunción analítica completa < BR > Laboratorio de recubrimiento de película fina
Comprimidos de montelukast sódico
Indicación
Este producto está destinado a la prevención y el tratamiento a largo plazo del asma en adultos mayores de 15 años, incluida la prevención de los síntomas del asma durante el día y la noche, el tratamiento de pacientes con asma que son sensibles a la aspirina y la prevención de la broncoconstricción inducida por el ejercicio. Este producto es adecuado para aliviar los síntomas causados por la rinitis alérgica (rinitis alérgica estacional y rinitis alérgica perenne en adultos mayores de 15 años).
Farmacología clínica
Montelukast sódico es una potente preparación oral que mejora significativamente la inflamación del asma. Los bioensayos bioquímicos y farmacológicos muestran que montelukast tiene una alta afinidad y selectividad por los receptores de cisteinil leucotrienos tipo I (CysLT1) (con otros receptores de vía aérea farmacológicamente importantes) Tales como prostaglandinas, receptores colinérgicos y β-adrenérgicos). Montelukast puede inhibir eficazmente los efectos fisiológicos producidos por la unión de LTC4, LTD4 y LTE4 al receptor CysLT1 sin ninguna actividad agonista del receptor. La investigación actual sugiere que montelukast no antagoniza el receptor CysLT2.
Uso y dosificación
Pacientes de 15 años de edad y mayores con asma y / o rinitis alérgica una vez al día, una tableta a la vez (10 mg). Los pacientes asmáticos deben tomarlo antes de acostarse. Los pacientes con rinitis alérgica estacional pueden tomar sus medicamentos cuando sea necesario de acuerdo con sus propias condiciones. Los pacientes con asma y rinitis alérgica deben recibir una vez por noche.
Formulación
Tableta
Especificación
10mg (según montelukast).
Manual de instrucciones
Fecha de aprobación: 13 de mayo de 2008
Fecha de revisión: 29 de julio de 2008
6 de enero de 2014 2016-4-21
Instrucciones de tabletas de Montelukast sódico
Lea atentamente las instrucciones y úselas bajo la guía de un médico.
[nombre de la droga]
Nombre común: tabletas de Montelukast sódico
Nombre en inglés: Montelukast Sodium Tablets
Pinyin chino: Menglusitena Pian
[Ingredientes] El ingrediente principal de este producto es montelukast sódico.
Nombre químico: [R- (E)] - 1 - [[[[1- [3- [2- (7-cloro-2-quinolina) vinil] fenil] -3- [2- (1-hidroxi) 1-metiletil) fenil] propil] tio] metil] ciclopropanoacetato de sodio.
Estructura química:
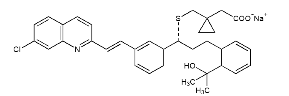
Fórmula molecular: C35H35ClNNaO3S Peso molecular: 608.17
[Propiedades] Este producto es una tableta recubierta con película amarilla, que es blanca o blanquecina después de retirar la capa de película.
[indicaciones]
Este producto está destinado a la prevención y el tratamiento a largo plazo del asma en adultos mayores de 15 años, incluida la prevención de los síntomas del asma durante el día y la noche, el tratamiento de pacientes con asma que son sensibles a la aspirina y la prevención de la broncoconstricción inducida por el ejercicio.
Este producto es adecuado para aliviar los síntomas causados por la rinitis alérgica (rinitis alérgica estacional y rinitis alérgica perenne en adultos mayores de 15 años).
[Especificación] 10mg (según Montelust).
[Uso y dosificación]
Pacientes de 15 años de edad y mayores con asma y / o rinitis alérgica una vez al día, una tableta a la vez (10 mg). Los pacientes asmáticos deben tomarlo antes de acostarse. Los pacientes con rinitis alérgica estacional pueden tomar sus medicamentos cuando sea necesario de acuerdo con sus propias condiciones.
Los pacientes con asma y rinitis alérgica deben recibir una vez por noche.
Consejos generales
El efecto terapéutico se evaluó mediante el índice de control del asma, y la eficacia del producto apareció dentro de un día de la administración del medicamento. Este producto puede tomarse con alimentos o servirse por separado. Se debe aconsejar a los pacientes que lo tomen independientemente del control o el deterioro del asma.
Los pacientes mayores, los pacientes con insuficiencia renal, los pacientes con daño hepático leve a moderado y los pacientes de diferentes géneros no necesitan ajustar la dosis.
Relación entre las tabletas de montelukast sódico y otros medicamentos para el tratamiento del asma
Este producto se puede agregar al plan de tratamiento existente del paciente.
Reduzca la dosis de la medicación combinada:
Broncodilatador:
En pacientes con asma que no pueden controlarse eficazmente con broncodilatador solo, este producto se puede agregar al régimen de tratamiento. Una vez que hay una respuesta clínica (generalmente después de la primera dosis), la dosis de broncodilatador se puede reducir de acuerdo con la tolerancia del paciente. .
Corticosteroides inhalados:
Para los pacientes con asma que reciben tratamiento con corticosteroides inhalados, la dosis de corticosteroides puede reducirse adecuadamente de acuerdo con la tolerancia del paciente. Debe reducirse gradualmente bajo supervisión médica. Algunos pacientes pueden reducir gradualmente la cantidad hasta que los corticosteroides inhalados se suspendan por completo. Sin embargo, este producto no debe usarse para reemplazar repentinamente los corticosteroides inhalados o como lo indique su médico.
【Reacciones adversas】
Este producto generalmente es bien tolerado, con efectos secundarios leves y generalmente no requiere la terminación del tratamiento. La incidencia general de reacciones adversas fue similar al placebo.
Pacientes con asma de 15 años y más
Se han realizado estudios clínicos en aproximadamente 2.600 pacientes adultos con asma de 15 años de edad y mayores para evaluar la seguridad de este producto. En dos estudios clínicos de 12 semanas, de diseño similar, controlados con placebo, la incidencia relacionada con el fármaco en el grupo de tratamiento fue ≥1% y los eventos adversos en el grupo placebo fueron dolor abdominal y dolor de cabeza. Sin embargo, la incidencia de estos eventos adversos no difirió significativamente entre los dos grupos.
En estudios clínicos, 544 pacientes se han acumulado con este producto durante al menos 6 meses, 253 pacientes durante 1 año y 21 pacientes durante 2 años. Con la prolongación del tiempo de tratamiento con este producto, la aparición de eventos adversos no cambió.
Pacientes con rinitis alérgica estacional de 15 años o más.
Se han realizado estudios clínicos en 2199 pacientes adultos con rinitis alérgica estacional de 15 años o más para evaluar la seguridad de este producto. Tomar este producto una vez al día o por la noche es bien tolerado, y la incidencia de reacciones adversas es similar a tomar un placebo. En un estudio clínico controlado con placebo, no se encontró una incidencia relacionada con el fármaco de ≥1% en el grupo de tratamiento y mayor que en el grupo de placebo. En un estudio clínico de 4 semanas controlado con placebo, el perfil de seguridad fue consistente con el estudio clínico de 2 semanas. En todos los estudios clínicos, la incidencia de letargo fue similar a la del grupo placebo.
Pacientes con rinitis alérgica perenne de 15 años y más
Se han llevado a cabo dos estudios clínicos de seis semanas controlados con placebo en 3.235 pacientes adultos con rinitis alérgica perenne de 15 años o más para evaluar la seguridad de este producto. El uso diario de este producto fue bien tolerado, y la incidencia de reacciones adversas fue similar a la del grupo placebo, y fue consistente con el estudio clínico de la rinitis alérgica estacional. En ambos estudios clínicos, la incidencia de eventos adversos fue inferior al 1% en el grupo de tratamiento y no se encontraron eventos relacionados con el fármaco, que fue mayor que los eventos adversos en el grupo placebo. La incidencia de letargo fue similar a la del grupo placebo.
Análisis combinado de la práctica clínica.
Se realizó un análisis agrupado de 41 estudios clínicos controlados con placebo (35 estudios para pacientes de 15 años de edad y mayores; 6 estudios para niños de 6 a 14 años) utilizando una evaluación efectiva de la conducta suicida. Entre 9929 pacientes que tomaron este producto y 7780 pacientes que tomaron placebo, un paciente con ideación suicida tomó este producto. No hubo acciones preparatorias para completar el suicidio, intentos de suicidio o comportamiento suicida en ningún grupo.
Para 46 estudios clínicos controlados con placebo (35 estudios para estudios elocuentes de 11 años de edad de niños de 15 años y mayores para niños entre 3 meses y 14 años de edad), se realizó un análisis combinado independiente para evaluar los eventos adversos relacionados con el comportamiento. La incidencia de eventos adversos relacionados con el comportamiento fue de 2.73% y 2.27% en pacientes que tomaron este producto a 11,673 y en 8827 pacientes que recibieron placebo; el odds ratio fue de 1.12 (IC 95 [0.93; 1.36]).
Los ensayos clínicos incluidos en estos análisis combinados no tenían tasas de suicidio de diseño específico o eventos adversos relacionados con el comportamiento.
Experiencia postcomercialización
Este producto tiene los siguientes informes de reacciones adversas después de su uso:
Infección e infección: infección del tracto respiratorio superior.
Trastornos de la sangre y del sistema linfático: aumento de la tendencia al sangrado.
Trastornos del sistema inmunitario: reacciones de hipersensibilidad, incluidas reacciones alérgicas, infiltración hepática muy rara de eosinófilos.
Trastornos del sistema mental: incluyendo comportamiento agresivo o excitación hostil, ansiedad, depresión, percepción de pérdida de dirección, falta de atención, sueños nocturnos, alucinaciones, insomnio, deterioro de la memoria, hipercinesia (incluida irritabilidad, inquietud) Y temblor), sonambulismo, pensamientos y comportamientos suicidas (suicidio).
Trastornos del sistema nervioso: mareos, letargo, parestesia / sensación táctil y convulsiones muy raras.
Trastorno cardíaco: palpitaciones.
Trastornos respiratorios, torácicos y mediastínicos: secreción nasal; eosinofilia pulmonar.
Trastornos gastrointestinales: diarrea, indigestión, náuseas, vómitos.
Trastornos hepatobiliares: ALT y AST elevados, hepatitis muy rara (incluidos colestásicos, hepatocitos y daño hepático mixto).
Trastornos de la piel y del tejido subcutáneo: angioedema, contusión, eritema multiforme, eritema nodular, picazón, erupción cutánea, urticaria.
Trastornos musculoesqueléticos y del tejido conectivo: dolor en las articulaciones, mialgia, incluidos espasmos musculares.
Otros trastornos y lugar de administración: debilidad / fatiga, edema, fiebre.
[Contraindicaciones] Está prohibido ser alérgico a cualquiera de los ingredientes de este producto.
【Notas】
No se ha determinado la eficacia de la administración oral de este producto en el tratamiento de los ataques agudos de asma. Por lo tanto, no debe usarse para tratar ataques de asma agudos.
Aunque la dosis de glucocorticoides inhalados puede reducirse gradualmente bajo la guía de un médico, este producto no se usa para reemplazar repentinamente los glucocorticoides inhalados u orales.
Los pacientes que toman este producto han informado un evento neurológico (ver Reacciones adversas). Dado que otros factores también pueden causar estos eventos, no es posible confirmar si está relacionado con este producto. El médico debe analizar estos eventos adversos con el paciente y / o el cuidador. Se debe informar al paciente y / o cuidador que se debe notificar al médico si se presentan estas condiciones.
En pacientes que reciben medicamentos antiasmáticos, incluidos los antagonistas de los receptores de leucotrienos, cuando se reduce la dosis de glucocorticoides sistémicos, ocurren muy pocos casos en uno o más de los siguientes casos: eosinofilia vascular Sarpullido, empeoramiento de los síntomas pulmonares, complicaciones cardíacas y / o neuropatía (a veces diagnosticadas como síndrome de Churg-Strauss, una vasculitis eosinofílica sistémica). Aunque no se ha determinado la relación causal entre estas afecciones y los antagonistas de los receptores de leucotrienos, se recomienda que se preste atención al monitoreo clínico apropiado al reducir la dosis sistémica de glucocorticoides en pacientes que reciben este producto.
[Mujeres embarazadas y mujeres lactantes]
Para las mujeres embarazadas sin datos de investigación, las mujeres embarazadas deben evitar tomar este producto a menos que se les exija explícitamente tomar el medicamento.
La experiencia después del marketing global muestra que hay informes poco frecuentes de defectos congénitos de las extremidades en los recién nacidos después de usar este producto durante el embarazo. La mayoría de estas mujeres también usan otros tratamientos para el asma durante el embarazo. No se ha establecido la relación causal entre el uso de este producto y estos eventos.
No está claro si este producto puede secretarse de la leche. Dado que la leche puede secretar muchos medicamentos, las mujeres en periodo de lactancia deben usar este producto con precaución.
[Medicación para niños]
Para pacientes de 15 a 18 años, consulte [Uso y dosificación]. Los estudios han demostrado que este producto no afecta la tasa de crecimiento de los niños. Esta especificación de producto no es adecuada para niños menores de 15 años.
[Uso geriátrico] En estudios clínicos, no hay diferencia de edad en la efectividad y seguridad de este producto.
[interacción farmacológica]
Este producto se puede combinar con otros medicamentos comúnmente utilizados para la prevención y el tratamiento a largo plazo del asma y para el tratamiento de la rinitis alérgica. En estudios de interacción farmacológica, la dosis recomendada de este producto no tiene efectos farmacocinéticos clínicamente significativos sobre los siguientes fármacos: teofilina, prednisona, prednisolona, anticonceptivos orales (etinilestradiol / noretisterona) 35/1), terfenadina, digoxina y warfarina.
En pacientes con fenobarbital combinado, el área bajo la curva de concentración plasmática-tiempo (AUC) de montelukast se redujo en aproximadamente un 40%. Sin embargo, no se recomienda ajustar la dosis de este producto.
Las pruebas in vitro han demostrado que montelukast es un inhibidor de CYP2C8. Sin embargo, un estudio clínico de las interacciones farmacológicas entre montelukast y rosiglitazone, un sustrato de sonda típico que es metabolizado principalmente por CYP2C8, sugiere que montelukast no inhibe CYP2C8 in vivo. Por lo tanto, se cree que montelukast no afecta a los medicamentos que son metabolizados por esta enzima (p. Ej., Paclitaxel, rosiglitazona, repaglinida).
【Sobredosis de drogas】
No existe información específica sobre la sobredosis de este producto en el tratamiento clínico. En el estudio del asma crónica, los pacientes adultos usaron una dosis de hasta 200 mg por día durante 22 semanas, y la dosis utilizada en el estudio a corto plazo fue tan alta como 900 mg por día durante aproximadamente 1 semana. No ocurrieron eventos adversos clínicamente significativos.
Ha habido informes de sobredosis aguda de drogas después de la comercialización y estudios clínicos con este producto. Esto incluye informes de dosis de hasta 1000 mg para adultos y niños. Los hallazgos clínicos y de laboratorio muestran constantemente su seguridad tanto en pacientes adultos como pediátricos. En la mayoría de los informes de sobredosis de drogas, no hubo eventos adversos. Los eventos adversos más comunes son consistentes con las características de seguridad, que incluyen dolor abdominal, letargo, sed, dolor de cabeza, vómitos e hipercinesia.
No está claro si este producto puede eliminarse por peritoneal o hemodiálisis.
【Farmacología y Toxicología】
Farmacología
Montelukast sódico es una potente preparación oral que mejora significativamente la inflamación del asma. Los bioensayos bioquímicos y farmacológicos muestran que montelukast tiene una alta afinidad y selectividad por los receptores de cisteinil leucotrienos tipo I (CysLT1) (con otros receptores de vía aérea farmacológicamente importantes) Tales como prostaglandinas, receptores colinérgicos y β-adrenérgicos). Montelukast puede inhibir eficazmente los efectos fisiológicos producidos por la unión de LTC4, LTD4 y LTE4 al receptor CysLT1 sin ninguna actividad agonista del receptor. La investigación actual sugiere que montelukast no antagoniza el receptor CysLT2.
Toxicología
Toxicidad por dosis repetidas: en la prueba de toxicidad de 14 semanas en monos y ratones, los monos y las ratas mostraron buena tolerancia al montelukast sódico. No se encontraron efectos de toxicidad en los indicadores toxicológicos cuando se usó al menos una dosis recomendada para humanos de al menos 125 veces la dosis recomendada de montelukast sódico para ninguno de los animales probados.
Genotoxicidad: no se ha encontrado que Montelukast sódico sea genotóxico y mutagénico. En la prueba de mutación microbiana in vitro y la prueba de mutación de células de mamífero V-79, montelukast sódico fue negativo en presencia o ausencia de actividad metabólica. En la prueba de elución alcalina de células hepáticas de rata y la prueba de aberración cromosómica de células de ovario de hámster chino in vitro, no hubo efecto genotóxico con o sin el sistema de actividad enzimática microsomal. De manera similar, cuando se administraron por vía oral ratones machos o hembras hasta 1200 mg / kg (3600 mg / m2) (6000 veces la dosis diaria recomendada para adultos, 50 kg de peso adulto) de montelukast sódico, no se indujeron anormalidades cromosómicas en las células de la médula ósea. El rol
Toxicidad para la reproducción: en ratas macho, la dosis de montelukast sódico oral fue tan alta como 800 mg / kg / día y la dosis oral de ratas hembras fue tan alta como 100 mg / kg / día. No se encontraron efectos sobre la fertilidad y la fertilidad. Estas dosis son respectivamente 4000 y 500 veces más altas que la dosis recomendada para adultos (basado en el peso adulto de 50 kg).
En el estudio de toxicidad del desarrollo, no se encontraron efectos adversos asociados con el tratamiento en ratas cuando la dosis era tan alta como 400 mg / kg / día y cuando la dosis de montelukast sódico era tan alta como 100 mg / kg / día en conejos. De hecho, hubo un caso en el que el feto estuvo expuesto al montelukast sódico en ratas y conejos, y el montelukast sódico se detectó claramente en la leche de las ratas lactantes.
Carcinogenicidad: en el estudio de dosis orales de hasta 200 mg / kg / día durante 106 semanas en ratas y dosis orales de hasta 100 mg / kg / día durante 92 semanas en ratones, no se encontró que la eficacia clínica de montelukast sódico sea cancerígena. Estas dosis son equivalentes a 1000 veces y 500 veces la dosis recomendada para adultos (según el peso adulto de 50 kg).
[Farmacocinética]
Absorber
La absorción oral de montelukast es rápida y completa. Después de tomar 10 mg de las tabletas recubiertas con película con el estómago vacío, la concentración plasmática alcanzó un pico de concentración (Cmax) a las 3 horas (Tmax). La biodisponibilidad oral promedio fue del 64%. La dieta ordinaria no tiene efecto sobre la biodisponibilidad oral y la Cmáx. Los estudios clínicos han demostrado que montelukast sódico, que toma 10 mg de tabletas recubiertas con película en cualquier momento después de comer, es seguro y efectivo.
Distribución
Más del 99% del montelukast sódico se une a las proteínas plasmáticas. El volumen de distribución en estado estable de montelukast es de 8 a 11 litros en promedio. Los estudios de montelukast marcado con isótopos en ratas han demostrado que solo una cantidad muy pequeña de montelukast pasa a través de la barrera hematoencefálica. Además, la cantidad de radiomarcaje en todos los demás tejidos fue extremadamente pequeña 24 horas después de la administración.
Metabolismo
Montelukast se metaboliza casi por completo. En el estudio con dosis terapéuticas, no se detectaron metabolitos de montelukast en plasma en el estado estacionario de adultos y niños.
Los estudios que utilizan microsomas hepáticos humanos in vitro han demostrado que el citocromo P450 3A4 y 2C9 están involucrados en el metabolismo de montelukast. Según otros estudios de microsomas hepáticos humanos in vitro, la concentración plasmática de la dosis de tratamiento con montelukast no inhibe el citocromo P450 3A4, 2C9, 1A2, 2A6, 2C19 o 2D6.
Excreción
El aclaramiento plasmático medio de montelukast en adultos sanos fue de 45 ml / min. Después de montelukast marcado con isótopos orales, se detectó el 86% de la radiactividad en las heces recolectadas durante los siguientes 5 días, y la cantidad medida en orina fue <0.2%. En combinación con la biodisponibilidad oral de montelukast, montelukast y sus metabolitos se excretan casi exclusivamente por vía biliar.
Muchos estudios realizados en jóvenes sanos han demostrado que la vida media plasmática media de montelukast es de 2.7 a 5.5 horas. La farmacocinética de montelukast se aproxima a una relación lineal en el rango de dosis orales de hasta 50 mg. No hubo diferencias en la farmacocinética de tomar montelukast por la mañana y por la noche. Al tomar 10 mg de montelukast una vez al día, solo una pequeña cantidad del medicamento original se acumuló en el plasma (~ 14%).
Paciente especial
No es necesario ajustar la dosis para ancianos, pacientes con insuficiencia renal o pacientes con insuficiencia hepática leve a moderada. Los datos clínicos sobre montelukast no estaban disponibles en pacientes con insuficiencia hepática grave (puntuación de Child-Pugh> 9).
[Almacenamiento] Proteger de la luz, sellar y almacenar en un lugar fresco (no más de 20 ° C).
[Embalaje] Embalaje doble de aluminio. 6 piezas / caja, 12 piezas / caja, 18 piezas / caja, 24 piezas / caja.
[Período de validez] 36 meses.
[Normas ejecutivas] Norma nacional de la Administración de Alimentos y Medicamentos YBH04912008
[Aprobación No.] Guoyao Zhunzi H20083372
[Fabricante]
Nombre de la empresa: Lunan Beite Pharmaceutical Co., Ltd.
Dirección de producción: No. 243, Yinqueshan Road, ciudad de Linyi, provincia de Shandong
Código postal: 276006
Número de teléfono: 0539-8336336 (Ventas) 8336337 (Departamento de gestión de calidad)
Número de fax: 0539-8336029 (Ventas) 8336338 (Departamento de gestión de calidad)
Sitio web: www.lunan.com.cn
Línea directa de atención al cliente las 24 horas: 400-0539-310
