Rosuvastatina tabletas de calcio
DescripciónFunción analítica completa < BR > Laboratorio de recubrimiento de película fina
Rosuvastatina tabletas de calcio
Indicación
Este producto es adecuado para la hipercolesterolemia primaria (tipo IIa, incluida la hipercolesterolemia familiar heterocigótica) que no está adecuadamente controlada por el control de la dieta y otros tratamientos no farmacológicos (p. Ej., Terapia con ejercicios, pérdida de peso) o Dislipidemia mixta (tipo IIb). Este producto también es adecuado para pacientes con hipercolesterolemia familiar homocigótica, como complemento del control de la dieta y otras medidas de reducción de lípidos (como la terapia de eliminación de LDL), o cuando estos métodos no son aplicables.
Farmacología clínica
La rosuvastatina es un inhibidor selectivo y competitivo de la HMG-CoA reductasa. La HMG-CoA reductasa es la enzima limitante de la velocidad en la conversión de la 3-hidroxi-3-metilglutaril coenzima A en mevalonato, que es un precursor del colesterol. Los experimentos con animales y los resultados de las pruebas de cultivo celular muestran que la rosuvastatina es altamente y altamente selectiva en el hígado, y el hígado es un órgano objetivo para reducir el colesterol. Las pruebas in vivo e in vitro han demostrado que la rosuvastatina puede aumentar el número de receptores de LDL hepáticos en la superficie celular, mejorando así la captación y catabolismo de LDL e inhibiendo la síntesis de VLDL en el hígado, reduciendo así el número total de partículas de VLDL y LDL. Para pacientes con hipercolesterolemia familiar homocigota y heterocigótica, pacientes con hipercolesterolemia no familiar, pacientes con dislipidemia mixta, la rosuvastatina puede reducir los niveles de colesterol total, LDL-C, ApoB, no HDL-C. La rosuvastatina también reduce el TG y eleva los niveles de HDL-C. Para los pacientes con hipertrigliceridemia sola, rosuvastatina redujo los niveles de colesterol total, LDL-C, VLDL-C, ApoB, no HDL-C, TG y niveles elevados de HDL-C. No se han determinado los efectos de rosuvastatina sobre la morbilidad y mortalidad cardiovascular.
Uso y dosificación
Los pacientes deben recibir un control de dieta estándar para reducir el colesterol antes del inicio del tratamiento y mantener el control de la dieta durante el tratamiento. El uso de este producto debe seguir el principio de individualización, teniendo en cuenta el nivel de colesterol individual del individuo, el riesgo cardiovascular esperado y el riesgo potencial de reacciones adversas ... (ver instrucciones)
Formulación
Tableta
Especificación
(1) 5 mg; (2) 10 mg; (3) 20 mg
Manual de instrucciones
Fecha de aprobación: 4 de mayo de 2008
Fecha de revisión: 13 de marzo de 2012
10 de diciembre de 2013
Instrucciones de tabletas de calcio de rosuvastatina
Lea atentamente las instrucciones y úselas bajo la guía de un médico.
[nombre de la droga]
Nombre común: tabletas de calcio rosuvastatina
Nombre en inglés: Rosuvastatin Calcium Tablets
Pinyin chino: Ruishufatatinggai Pian
[Ingredientes] El ingrediente principal de este producto es rosuvastatina de calcio.
Nombre químico: bis - [(E) -7- [4- (4-fluorofenil) -6-isopropil-2- [metil (metilsulfonil) amino] -pirimidin-5-il] ( Ácido 3R, 5S) -3,5-dihidroxihept-6-enoico] sal de calcio (2: 1)
Estructura química:
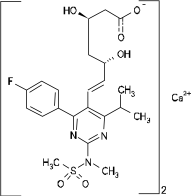
Fórmula molecular: (C22H27FN3O6S) 2Ca Peso molecular: 1001.15
【Propiedades】 Este producto es una tableta recubierta con película, que es blanca o blanquecina después de retirar el recubrimiento.
[indicaciones]
Este producto es adecuado para la hipercolesterolemia primaria (tipo IIa, incluida la hipercolesterolemia familiar heterocigótica) que no está adecuadamente controlada por el control de la dieta y otros tratamientos no farmacológicos (p. Ej., Terapia con ejercicios, pérdida de peso) o Dislipidemia mixta (tipo IIb).
Este producto también es adecuado para pacientes con hipercolesterolemia familiar homocigótica, como complemento del control de la dieta y otras medidas de reducción de lípidos (como la terapia de eliminación de LDL), o cuando estos métodos no son aplicables.
[Especificaciones] según rosuvastatina (C22H27FN3O6S)
(1) 5 mg; (2) 10 mg; (3) 20 mg
[Uso y dosificación]
Los pacientes deben recibir un control de dieta estándar para reducir el colesterol antes de iniciar el tratamiento y mantener el control de la dieta durante el tratamiento. El uso de este producto debe seguir el principio de individualización, teniendo en cuenta el nivel de colesterol individual del individuo, el riesgo cardiovascular esperado y el riesgo potencial de reacciones adversas.
Oral Este producto generalmente se usa en una dosis inicial de 5 mg una vez al día. La elección de la dosis inicial debe tener en cuenta los niveles individuales de colesterol del individuo, el riesgo cardiovascular esperado y el riesgo potencial de reacciones adversas. Para aquellos pacientes que necesitan reducir de manera más efectiva el LDL-C (LDL-C), 10 mg una vez al día pueden considerarse una dosis inicial, que puede controlar los niveles de lípidos en la sangre en la mayoría de los pacientes. Si es necesario, la dosis se puede ajustar a un nivel más alto después de 4 semanas de tratamiento. La dosis diaria máxima de este producto es de 20 mg.
Este producto puede administrarse en cualquier momento del día y puede tomarse mientras se come o con el estómago vacío.
Pacientes con medicación para insuficiencia renal
Los pacientes con insuficiencia renal leve y moderada no necesitan ajustar la dosis. Todas las dosis de este producto están contraindicadas en pacientes con insuficiencia renal grave.
Uso de drogas en pacientes con daño hepático
En sujetos con una puntuación de Child-Pugh no superior a 7, la exposición sistémica a rosuvastatina no fue elevada. En sujetos con puntajes de Child-Pugh de 8 y 9, se observó un aumento en la exposición sistémica. En estos pacientes, se debe considerar una evaluación de la función renal. No hay experiencia en el uso de este producto en pacientes con una puntuación de Child-Pugh superior a 9. Este producto está contraindicado en pacientes con enfermedad hepática activa.
Carrera
Se ha observado un aumento en la exposición sistémica en sujetos asiáticos. Este factor debe considerarse al determinar la dosis de un paciente con ascendencia asiática.
【Reacciones adversas】
Las reacciones adversas observadas en este producto suelen ser leves y transitorias. En ensayos clínicos controlados en el extranjero, menos del 4% de los pacientes se retiraron del ensayo debido a eventos adversos.
La frecuencia de los eventos adversos se organiza en el siguiente orden: frecuentes (incidencia> 1/100, <1/10); raros (> 1/1000, <1/100); raros (> 1/10000, <1/1000); Muy raro (<1/10000).
Anormalidad del sistema inmune
Raras: reacciones alérgicas, incluido angioedema.
Anormalidad del sistema nervioso
Frecuentes: dolor de cabeza, mareos.
Tracto gastrointestinal anormal
Frecuentes: estreñimiento, náuseas, dolor abdominal.
Piel y tejido subcutáneo anormales.
Raras: picazón, erupción cutánea y urticaria.
Músculo esquelético, articulaciones y anomalías óseas
Frecuentes: mialgia.
Raras: miopatía y rabdomiólisis.
Cuerpo anormal
Común: impotente
Al igual que otros inhibidores de la HMG-CoA reductasa, la incidencia de reacciones adversas en este producto tiende a aumentar con el aumento de la dosis.
Efectos sobre el riñón: se observó proteinuria (prueba de tira reactiva) en pacientes que recibieron este producto, y la mayor parte de la proteína se obtuvo de los túbulos renales. Aproximadamente el 1% de los pacientes tuvo un aumento mínimo o nulo en la proteinuria a ++ o más durante ciertos períodos de 10 mg y 20 mg de tratamiento, que fue aproximadamente el 3% en pacientes que recibieron 40 mg de tratamiento. En el tratamiento de dosis de 20 mg, se observó un ligero aumento de proteinuria de cero o ligeramente aumentado a +. En la mayoría de los casos, la proteinuria se reduce o desaparece automáticamente después de continuar el tratamiento.
Efectos sobre el músculo esquelético: Existen informes de efectos sobre el músculo esquelético en pacientes que reciben varias dosis de este producto, como mialgia, miopatía y rabdomiólisis rara, especialmente en pacientes con dosis superiores a 20 mg. .
Se observó que los niveles elevados de creatina quinasa (CK) estaban relacionados con la dosis en pacientes que tomaban este producto; la mayoría de los casos fueron leves, asintomáticos y transitorios. Si los niveles de CK están elevados (> 5 x ULN), se debe suspender el tratamiento.
Efectos sobre el hígado: Al igual que con otros inhibidores de la HMG-CoA reductasa, se observaron elevaciones de las transaminasas relacionadas con la dosis en un pequeño número de pacientes que tomaron este producto; la mayoría de los casos fueron leves, asintomáticos y transitorios.
Experiencia postcomercialización: el monitoreo postcomercialización de las estatinas tiene informes de hiperglucemia, intolerancia a la glucosa, niveles elevados de hemoglobina glucosilada, diabetes de inicio reciente, empeoramiento del control glucémico y algunas estatinas tienen informes de hipoglucemia.
Hay casos raros de deterioro cognitivo en la vigilancia postcomercialización de las estatinas, que son pérdida de memoria, pérdida de memoria, confusión, etc., en su mayoría reacciones reversibles no graves, que pueden recuperarse después de suspender el medicamento.
Además de las reacciones anteriores, se informaron los siguientes eventos adversos durante el uso posterior a la comercialización de este producto:
Enfermedades hepatobiliares:
Muy raros: ictericia, hepatitis;
Raras: elevación de las transaminasas hepáticas.
Trastornos musculoesqueléticos:
Raras: dolor en las articulaciones.
Enfermedades del sistema nervioso:
Muy raros: polineuropatía.
[tabú]
Este producto tiene prohibido:
● Aquellos que son alérgicos a la rosuvastatina o cualquiera de los ingredientes de este producto.
Pacientes con enfermedad hepática activa, incluidos pacientes con transaminasas séricas elevadas inexplicables y cualquier transaminasa sérica elevada que exceda 3 veces el límite superior de la normalidad (ULN).
● Pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml / min).
● Pacientes con miopatía.
● Pacientes que usan ciclosporina al mismo tiempo.
● Mujeres que están embarazadas, amamantando y que probablemente quedarán embarazadas sin la anticoncepción adecuada.
【Notas】
Efecto sobre el riñón
En dosis altas, especialmente en pacientes tratados con 40 mg, se observó proteinuria (prueba de tira reactiva). La mayor parte de la proteína se derivó de los túbulos renales. En la mayoría de los casos, la proteinuria fue transitoria o intermitente.
Efecto sobre el músculo esquelético.
Ha habido informes de efectos sobre el músculo esquelético en pacientes que reciben varias dosis de este producto, como mialgia, miopatía y rabdomiólisis rara, especialmente en pacientes con dosis superiores a 20 mg.
Ensayo de creatina quinasa
La creatina quinasa (CK) no debe detectarse después de un ejercicio extenuante o en presencia de factores plausibles que causen la elevación de CK, lo que confundiría la interpretación de los resultados. Si el valor base de CK aumenta significativamente (> 5 × ULN), la prueba debe confirmarse dentro de 5-7 días. Si las pruebas repetidas confirman que el valor basal de CK del paciente es> 5 x ULN, el tratamiento no puede comenzar.
Antes del tratamiento
Al igual que con otros inhibidores de la HMG-CoA reductasa, los pacientes con susceptibilidad a miopatía / rabdominio deben ser cautelosos al usar este producto.
Estos factores incluyen:
● Insuficiencia renal
● Hipotiroidismo
● Enfermedad muscular hereditaria en mi historia familiar
● Historia previa de toxicidad muscular de otros inhibidores de la HMG-CoA reductasa o fibratos
● Abuso de alcohol
● Edad> 70 años
● Posible aumento de la concentración sanguínea.
Para estos pacientes, debe considerarse la relación entre los posibles beneficios del tratamiento y los riesgos potenciales, y se recomienda la monitorización clínica. Si el valor basal de CK del paciente está significativamente elevado (> 5 x ULN), el tratamiento no debe comenzar.
En tratamiento
Se debe pedir a los pacientes que informen de inmediato el dolor muscular, la debilidad o los espasmos de causa desconocida, especialmente si van acompañados de molestias y fiebre. Estos pacientes deben ser evaluados para determinar los niveles de CK. El tratamiento debe suspenderse si el valor de CK está significativamente elevado (> 5 x ULN) o si los síntomas musculares son graves y causan molestias durante todo el día (incluso si CK ≤ 5 x ULN). Si los síntomas se resuelven y los niveles de CK vuelven a la normalidad, considere volver a administrar el producto o cambiar a la dosis más baja de otros inhibidores de la HMG-CoA reductasa y observar de cerca.
No se requieren pruebas regulares de los niveles de CK en pacientes asintomáticos.
En estudios clínicos, no hay evidencia de que los efectos de los medicamentos sobre el músculo esquelético aumenten en un pequeño número de pacientes que usan este producto y otros tratamientos. Sin embargo, se ha encontrado que otros inhibidores de la HMG-CoA reductasa y derivados del ácido berílico (incluido gemfibrozilo), ciclosporina, ácido nicotínico, agentes antifúngicos azólicos, inhibidores de la proteasa o antibióticos macrólidos La incidencia de miositis y miopatía aumentó en pacientes que se combinaron. El gemfibrozilo se usa en combinación con algunos inhibidores de la HMG-CoA reductasa para aumentar el riesgo de miopatía. Por lo tanto, este producto no se recomienda para usar con Gemfibrozil. Se debe tener cuidado de sopesar los beneficios de este producto en combinación con fibratos o niacina para mejorar aún más los niveles de lípidos y los riesgos potenciales de esta combinación.
Cualquier insuficiencia renal aguda o grave asociada con miopatía (como sepsis, hipotensión, cirugía mayor, trauma, anomalías metabólicas, endocrinas y electrolíticas graves, o epilepsia no controlada) Este producto no está disponible para pacientes.
Impacto en el hígado
Al igual que con otros inhibidores de la HMG-CoA reductasa, este producto debe usarse con precaución en pacientes con exceso de alcohol y / o enfermedad hepática. Se recomienda realizar pruebas de función hepática antes de comenzar el tratamiento y a los 3 meses después de comenzar. Si la transaminasa sérica aumenta más de 3 veces el límite superior de lo normal, este producto debe suspenderse o reducirse.
Para la hipercolesterolemia secundaria a hipotiroidismo o síndrome nefrótico, la enfermedad primaria debe tratarse antes de comenzar el tratamiento con este producto.
Carrera
Los estudios farmacocinéticos han demostrado que los sujetos asiáticos tienen exposiciones más altas que los caucásicos.
Impacto en la conducción de vehículos y la manipulación de máquinas.
No se han realizado investigaciones para determinar el impacto de este producto en la conducción de vehículos y la manipulación de máquinas. Sin embargo, dependiendo de las propiedades farmacodinámicas, es poco probable que este producto afecte estas capacidades. Al conducir un vehículo y manipular la máquina, se debe considerar que puede producirse vértigo durante el tratamiento.
[Mujeres embarazadas y mujeres lactantes]
Este producto está contraindicado en mujeres embarazadas y mujeres lactantes.
Las mujeres que puedan quedar embarazadas deben tomar las medidas anticonceptivas adecuadas.
Dado que el colesterol y otros productos de biosíntesis de colesterol son importantes para el desarrollo embrionario, el riesgo de inhibición de la HMG-CoA reductasa excede el beneficio del tratamiento para mujeres embarazadas. Los estudios en animales proporcionan evidencia de toxicidad reproductiva limitada. Si la paciente está embarazada durante el uso de este producto, el tratamiento debe suspenderse de inmediato. La rosuvastatina se puede secretar en la leche de rata. No hay información sobre la secreción de rosuvastatina en la leche humana.
[Medicación para niños]
No se ha establecido la seguridad y eficacia de este producto en niños. La experiencia del uso pediátrico se limita a un pequeño número de niños (edad ≥ 8 años) con hipercolesterolemia familiar homocigótica. Por lo tanto, actualmente no se recomienda que la pediatría use este producto.
[Uso geriátrico]
No hay necesidad de ajustar la dosis.
[interacción farmacológica]
Ciclosporina: cuando se usa en combinación con ciclosporina, el AUC de rosuvastatina fue 7 veces mayor que el observado en voluntarios sanos (en comparación con la misma dosis de este producto). El uso combinado no afecta la concentración plasmática de ciclosporina.
Antagonistas de la vitamina K: Al igual que con otros inhibidores de la HMG-CoA reductasa, comenzar a un paciente con un antagonista de la vitamina K (por ejemplo, warfarina) o aumentar gradualmente la dosis puede provocar un aumento de INR. Deshabilitar este producto o reducir gradualmente la dosis de este producto puede resultar en una disminución de INR. En este caso, es necesario detectar correctamente el INR.
Gemfibrozil y otros productos hipolipemiantes: este producto se puede usar en combinación con gemfibrozil para aumentar la Cmáx y el AUC de rosuvastatina en un factor de dos.
Según los datos de estudios de interacción especializados, se espera que este producto interactúe con fenofibrato sin farmacocinética, pero pueden producirse interacciones farmacodinámicas.
El gemfibrozilo, el fenofibrato, otros fibratos y las dosis hipolipemiantes (≥1 g / día) de niacina combinadas con inhibidores de la HMG-CoA reductasa aumentan el riesgo de miopatía, que puede deberse a que se separan Puede causar miopatía cuando se administra.
Antiácidos: la administración simultánea de este producto y una suspensión antiácida que contiene hidróxido de aluminio y magnesio redujo la concentración plasmática de rosuvastatina en aproximadamente un 50%. Si el antiácido se administra 2 horas después de tomar este producto, el efecto puede aliviarse. La importancia clínica de esta interacción farmacológica no se ha estudiado.
Eritromicina: este producto combinado con eritromicina dio como resultado una disminución del 20% en el AUC (0-t) y una disminución del 30% en la Cmáx de rosuvastatina. Esta interacción puede deberse a un aumento en la motilidad gastrointestinal causada por la eritromicina.
Anticonceptivo oral / terapia de reemplazo hormonal (TRH): el uso de este producto y los anticonceptivos orales aumentaron el AUC de etinilestradiol y norgestrel en un 26% y 34%, respectivamente. Estos aumentos en la concentración sanguínea deben considerarse al seleccionar una dosis de anticonceptivo oral. No hay datos farmacocinéticos para los sujetos que usan este producto y la TRH, por lo que no se pueden descartar interacciones similares. Sin embargo, en ensayos clínicos, esta combinación está ampliamente disponible y es bien tolerada por los pacientes.
Otros medicamentos: según los datos de estudios especializados de interacción farmacológica, se estima que no existe interacción clínicamente relevante entre este producto y la digoxina.
Enzimas del citocromo P450: Los estudios in vitro e in vivo han demostrado que la rosuvastatina no es un inhibidor de las isoenzimas P450 celulares ni un inductor enzimático. Además, la rosuvastatina es un sustrato débil para estas enzimas. No hay interacción clínicamente relevante entre rosuvastatina y fluconazol (un inhibidor de CYP 2CP y CYP 3A4) o ketoconazol (un inhibidor de CYP 2A6 y CYP 3A4). En combinación con itraconazol (un inhibidor del CYP 3A4), el AUC de rosuvastatina aumentó en un 28%, y este aumento no se consideró clínicamente significativo. Por lo tanto, se estima que no hay interacción farmacológica causada por el metabolismo mediado por el citocromo P450.
Inhibidores de la proteasa: aunque el mecanismo de las interacciones farmacológicas no está claro, la administración simultánea de inhibidores de la proteasa puede aumentar considerablemente la exposición a rosuvastatina. En el estudio farmacocinético, voluntarios sanos que tomaron una combinación de 20 mg de este producto y dos inhibidores de la proteasa (400 mg de lopinavir / 100 mg de ritonavir) mostraron el AUC en estado estacionario de rosuvastatina ( 0-24) y la Cmáx aumentaron aproximadamente 2 veces y 5 veces, respectivamente. Por lo tanto, no se recomienda usar este producto en pacientes con VIH tratados con inhibidores de la proteasa.
【Sobredosis de drogas】
No existe un tratamiento especial cuando este producto es una sobredosis. Una vez que ocurre una sobredosis, se debe administrar un tratamiento sintomático y se deben tomar medidas de apoyo cuando sea necesario. Se debe controlar la función hepática y los niveles de CK. La hemodiálisis puede no tener un efecto significativo.
【Farmacología y Toxicología】
Acción farmacológica
La rosuvastatina es un inhibidor selectivo y competitivo de la HMG-CoA reductasa. La HMG-CoA reductasa es la enzima limitante de la velocidad en la conversión de la 3-hidroxi-3-metilglutaril coenzima A en mevalonato, que es un precursor del colesterol. Los experimentos con animales y los resultados de las pruebas de cultivo celular muestran que la rosuvastatina es altamente y altamente selectiva en el hígado, y el hígado es un órgano objetivo para reducir el colesterol. Las pruebas in vivo e in vitro han demostrado que la rosuvastatina puede aumentar el número de receptores de LDL hepáticos en la superficie celular, mejorando así la captación y catabolismo de LDL e inhibiendo la síntesis de VLDL en el hígado, reduciendo así el número total de partículas de VLDL y LDL.
Para pacientes con hipercolesterolemia familiar homocigota y heterocigótica, pacientes con hipercolesterolemia no familiar, pacientes con dislipidemia mixta, la rosuvastatina puede reducir los niveles de colesterol total, LDL-C, ApoB, no HDL-C. La rosuvastatina también reduce el TG y eleva los niveles de HDL-C. Para los pacientes con hipertrigliceridemia sola, rosuvastatina redujo los niveles de colesterol total, LDL-C, VLDL-C, ApoB, no HDL-C, TG y niveles elevados de HDL-C. No se han determinado los efectos de rosuvastatina sobre la morbilidad y mortalidad cardiovascular.
Investigación toxicológica
Toxicidad del sistema nervioso central
En la prueba canina de varios medicamentos similares, se observó lesión vascular del SNC y se observó hemorragia perivascular, edema e infiltración de células mononucleares perivasculares. Un medicamento de estructura similar a esta clase de medicamentos exhibe degeneración del nervio óptico dependiente de la dosis (degeneración walleriana de la fibra del cuerpo de la retina-rodilla) a una dosis que es 30 veces más alta que la concentración media de la dosis humana máxima recomendada en perros.
A una perra se le administró por vía oral 90 mg / kg / día de rosuvastatina (calculada según el AUC, la exposición sistémica fue equivalente a 100 veces la exposición humana a 40 mg / día), y se sacrificó el día 24 debido a la muerte súbita, mostrando plexo coroideo Edema, hemorragia, necrosis parcial. Al perro se le administró rosuvastatina 6 mg / kg / día por vía oral (calculada según el AUC, la exposición sistémica fue equivalente a 20 veces la exposición humana a 40 mg / día) y la córnea estuvo turbia durante 52 semanas. Administración oral canina de rosuvastatina 30 mg / kg / día (según el AUC, la exposición sistémica es equivalente a 60 veces la exposición humana de 40 mg / día), durante 12 semanas, se pueden observar cataratas. La administración oral canina de rosuvastatina 90 mg / kg / día (según el AUC, la exposición sistémica es equivalente a 100 veces la exposición humana de 40 mg / día), durante 4 semanas, displasia retiniana visible y desprendimiento de retina. Los perros fueron administrados continuamente durante 1 año a dosis ≤ 30 mg / kg / día (calculado por AUC, exposición sistémica equivalente a 60 veces la exposición a 40 mg / día humanos), y no se observó ningún efecto sobre la retina.
Genotoxicidad
Los resultados de rosuvastatina en la prueba de Ames, la prueba de linfoma de ratón, la prueba de aberración cromosómica de células CHL y la prueba de micronúcleo de ratón fueron negativos.
Toxicidad reproductiva
En la prueba de fertilidad en ratas, a las ratas macho se les administró oralmente 5, 15, 50 mg / kg / día desde la novena semana antes del apareamiento hasta el período de apareamiento, y 2 semanas antes del apareamiento de las ratas hembra, a la dosis más alta (según el AUC). Se estima que la exposición sistémica es equivalente a 10 veces la exposición de 40 mg / día en humanos, sin efectos adversos sobre la fertilidad. El perro se administró por vía oral con rosuvastatina 30 mg / kg / día durante 1 mes, y se observó el espermatóforo (célula gigante espermatídica) en los testículos. Los monos recibieron rosuvastatina 30 mg / kg / día durante 6 meses, y los macrófagos y los conductos deferentes fueron vacuolados. Las dosis anteriores de perros y monos se estimaron en 20 y 10 veces la superficie corporal de 40 mg / día, respectivamente. Fenómenos similares se pueden ver con medicamentos similares.
Las ratas hembras se administraron por vía oral 5, 15, 50 mg / kg / día 7 días después del apareamiento, y el grupo de dosis alta (calculado como AUC, la exposición sistémica fue equivalente a 10 veces la exposición humana a 40 mg / día). Osificación retrasada.
Las ratas se administraron por vía oral 2, 10, 50 mg / kg / día desde el séptimo día de embarazo hasta el día 21 de lactancia (destete), y el grupo de dosis alta (calculado por el área de superficie corporal, 12 veces o más de 40 mg / día humano) La tasa de supervivencia del niño se reduce. Los conejos se administraron por vía oral 0.3, 1, 3 mg / kg / día desde el sexto día de gestación hasta el día 18 de lactancia (destete) (calculado por el área de superficie corporal, equivalente a 40 mg / día), mostrando una disminución en la tasa de supervivencia fetal, animal materno Muerte La dosis de rosuvastatina fue ≤25 mg / kg / día en ratas y ≤3 mg / kg / día en conejos.No se encontró teratogenicidad (calculada como AUC y área de superficie corporal, respectivamente, comparable a la exposición humana a 40 mg / día).
Carcinogenicidad
En la prueba de carcinogenicidad de 104 semanas en ratas, la dosis oral fue de 2, 20, 60, 80 mg / kg / día. 80 mg / kg / día (calculado por AUC, la exposición sistémica es equivalente a 20 veces la exposición humana a 40 mg / día). La incidencia de pólipos uterinos aumentó significativamente en el grupo femenino del grupo de dosis, y la incidencia no aumentó a dosis bajas.
En la prueba de carcinogenicidad de 107 semanas de ratones, la dosis oral fue de 10, 60, 200 mg / kg / día. 200 mg / kg / día (calculado por AUC, la exposición sistémica es equivalente a 20 veces la exposición humana a 40 mg / día). El grupo de dosis mostró un aumento en adenoma / carcinogénesis hepatocelular, y ningún aumento en dosis bajas.
[Farmacocinética]
El estudio farmacocinético de rosuvastatina caucásica mostró:
Absorción: la concentración sanguínea alcanzó su punto máximo después de 5 horas de administración oral. La biodisponibilidad absoluta es del 20%.
Distribución: Rosuvastatin es ingerido en grandes cantidades por el hígado, que es el sitio principal de síntesis de colesterol y eliminación de LDL-C. El volumen de distribución de rosuvastatina es de aproximadamente 134L. La tasa de unión a proteínas plasmáticas (principalmente albúmina) de rosuvastatina es de aproximadamente 90%.
Metabolismo: metabolismo limitado de rosuvastatina (alrededor del 10%). Los estudios metabólicos in vitro con hepatocitos humanos han demostrado que la rosuvastatina es un sustrato débil para el metabolismo del citocromo P450. Las principales isoenzimas involucradas en el metabolismo son CYP, 2C9, 2C19, 3A4 y 2D6, que están menos involucradas en el metabolismo. Los metabolitos conocidos son los metabolitos de N-demetil y lactona. La actividad del metabolito N-demetil es 50% menor que la de la rosuvastatina, mientras que el metabolito de lactona se considera clínicamente inactivo.
Más del 90% de la actividad inhibitoria contra la HMG-CoA reductasa circulante es de rosuvastatina.
Excreción: aproximadamente el 90% de la dosis de rosuvastatina se excreta en la forma original con heces (incluidos los activos absorbidos y no absorbidos) y el resto se excreta en la orina. Alrededor del 5% de la orina tiene la forma original. La vida media de eliminación plasmática es de aproximadamente 19 horas. La vida media de eliminación no aumenta con el aumento de la dosis. La media geométrica del aclaramiento plasmático fue de aproximadamente 50 l / h (coeficiente de variación del 21,7%). Al igual que otros inhibidores de la HMG-CoA reductasa, la absorción de rosuvastatina por el hígado involucra el transportador de membrana OATP-C. Este transportador es importante en el aclaramiento hepático de rosuvastatina.
Linealidad: la exposición sistémica a rosuvastatina aumentó proporcionalmente con la dosis. Los parámetros farmacocinéticos después de múltiples administraciones no cambiaron.
Solo alrededor del 10% de la dosis oral de rosuvastatina se metaboliza, principalmente la N-desmetilación.
Población especial:
Edad y sexo: la edad o el sexo no tienen un efecto clínicamente significativo sobre la farmacocinética de rosuvastatina.
Insuficiencia renal: en un estudio realizado en el extranjero para pacientes con diversos grados de insuficiencia renal, la enfermedad renal leve y moderada no tuvo efecto sobre las concentraciones plasmáticas de rosuvastatina o metabolitos de N-desmetilo. Sin embargo, en comparación con voluntarios sanos, los pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml / min) tuvieron un aumento de 3 veces en la concentración plasmática y un aumento de 9 veces en las concentraciones plasmáticas de metabolitos de N-desmetilo. La concentración plasmática en estado estacionario de rosuvastatina en pacientes en hemodiálisis es aproximadamente un 50% más alta que la de los voluntarios sanos.
Insuficiencia hepática: en un estudio de pacientes con diversos grados de insuficiencia hepática en países extranjeros, no hubo evidencia de que los sujetos con una puntuación de Child-Pugh de no más de 7 hubieran aumentado la exposición, pero 2 casos tenían una puntuación de Child-Pugh de 8 En pacientes con -9, su exposición a rosuvastatina fue al menos 2 veces mayor que aquellos con puntajes menores de Child-Pugh. No hay experiencia con sujetos con un puntaje de Child-Pugh de más de 9.
Etnicidad: estudios farmacocinéticos extranjeros han demostrado que la mediana y la concentración máxima (Cmáx) del área bajo la curva de concentración plasmática-tiempo (AUC) de los sujetos asiáticos (incluidos los chinos) es aproximadamente la de los caucásicos occidentales. 2 veces El análisis farmacocinético de la población mostró. No hubo diferencias clínicamente relevantes en farmacocinética entre los grupos caucásicos y negros.
Los estudios han demostrado que después de una dosis única de voluntarios sanos chinos, la mediana de tmax varió de 2.5 a 5 horas, seguida de una disminución exponencial. La vida media (t1 / 2) es de aproximadamente 11 a 12 horas. Al tercer día de la administración múltiple, la concentración plasmática alcanzó el estado estacionario. La acumulación de drogas después de múltiples administraciones es pequeña. E independientemente de la dosis.
[Almacenamiento] sombreado, sellado y almacenado en un lugar fresco (no más de 20 ° C).
[Embalaje] Embalaje doble de aluminio, 7 piezas / caja, 14 piezas / caja, 21 piezas / caja, 28 piezas / caja.
[Período de validez] 24 meses
[Normas ejecutivas] Norma nacional de la Administración de Alimentos y Medicamentos YBH04172008
[Número de aprobación]
(1) 5 mg: cuasi-palabra de medicina china H20080240;
(2) 10 mg: National Drug Standard H20080241;
(3) 20 mg: Norma Nacional de Drogas H20080242.
[Fabricante]
Nombre de la empresa: Lunan Beite Pharmaceutical Co., Ltd.
Dirección de producción: No. 243, Yinqueshan Road, ciudad de Linyi, provincia de Shandong
Código postal: 276006
Número de teléfono: 0539-8336336 (Ventas) 8336337 (Departamento de gestión de calidad)
Número de fax: 0539-8336029 (Ventas) 8336338 (Departamento de gestión de calidad)
Sitio web: www.LUNAN.com.cn
Línea directa de atención al cliente las 24 horas: 400-0539-310
