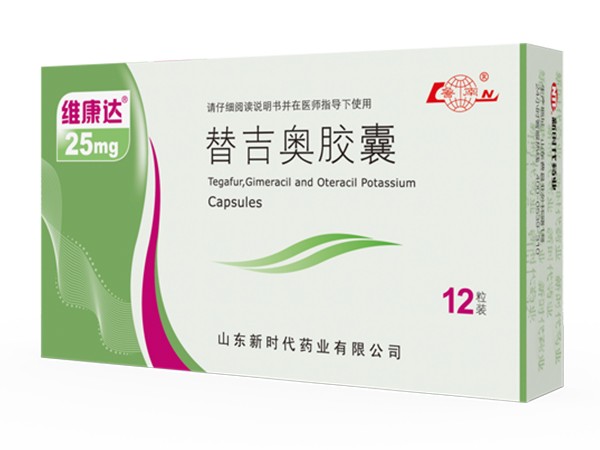
Cápsula de Tiggio
DescripciónFunción analítica completa < BR > Laboratorio de recubrimiento de película fina
Cápsula de Tiggio
Indicación
Cáncer gástrico localmente avanzado o metastásico que no se puede extirpar.
Farmacología clínica
1. Efecto antitumoral Tiggio puede inhibir el crecimiento de cáncer gástrico humano, cáncer colorrectal, cáncer de mama, cáncer de pulmón, cáncer de páncreas y cáncer renal trasplantado en ratones desnudos (rata y ratón), y prolongar el cáncer de pulmón de Lewis y la metástasis L5178Y en ratones. Modelo de tiempo de supervivencia. 2. Mecanismo de acción La cápsula de Tiggio consta de tegafur (FT), gemcitabina (CDHP) y oxilatino-potasio (Oxo). Su mecanismo de acción es: FT se convierte gradualmente en 5-fluorouracilo (5-FU) en el cuerpo después de la administración oral. El CDHP inhibe selectivamente de forma reversible la enzima catabólica 5-FU, DPD, presente en el hígado, aumentando así la concentración de 5-FU del FT. Junto con el aumento de la concentración de 5-FU en el cuerpo, el producto de fosforilación de 5-FU 5-fluoronucleótido en los tejidos tumorales puede mantener una alta concentración, mejorando así el efecto antitumoral. Oxo se distribuye en el tracto gastrointestinal después de la administración oral, y puede inhibir selectivamente de forma reversible la orotato de fosforibosiltransferasa, inhibiendo selectivamente la conversión de 5-FU en 5-fluoronucleótido, lo que no afecta la actividad antitumoral de 5-FU. Reduce los efectos secundarios gastrointestinales. El principal mecanismo de acción de 5-FU es unirse competitivamente a la timidina sintasa por sus metabolitos activos FdUMP y dUMP, y formar un trímero con folato reducido, inhibiendo así la síntesis de ADN. Además, el 5-FU se convierte en FUTP y se integra en las moléculas de ARN, lo que altera la función del ARN.
Uso y dosificación
Cápsula de Tiggio combinada con cisplatino para el tratamiento de pacientes no resecables con cáncer gástrico localmente avanzado o metastásico ... (ver instrucciones)
Formulación
Cápsula
Especificación
(1) Especificación de 20 mg: tegafur 20 mg, gemcitabina 5,8 mg y oltipraz potásico 19,6 mg.
(2) Especificación de 25 mg: 25 mg de tegafur, 7,25 mg de gemcitabina y 24,5 mg de oltipraz de potasio.
Manual de instrucciones
Fecha aprobada el 19 de diciembre de 2008
Fecha de modificación 1) 12 de enero de 2010
2) 01 de febrero de 2010
3) 18 de julio de 2011
Instrucciones de la cápsula de Tiggio
Lea atentamente las instrucciones y úselas bajo la guía de un médico.
[Advertencia]
1. Este medicamento solo se puede usar en pacientes con cáncer que necesitan usar cápsulas de Tiggio. Los pacientes deben ser atendidos en un hospital con instalaciones de primeros auxilios y bajo la guía de un médico con amplia experiencia en quimioterapia contra el cáncer. Lea las instrucciones para todos los medicamentos concomitantes antes de decidir usar el régimen de quimioterapia que contiene cápsulas de Teggio. Antes del comienzo de la quimioterapia, se debe explicar al paciente en detalle sobre la eficacia y el riesgo, y obtener el consentimiento informado del paciente o su tutor.
2. A diferencia de los fluorouracilos orales tradicionales, la toxicidad limitante de la dosis (DLT) de las cápsulas de Tiggio es la mielosupresión (ver [Reacciones adversas] para más detalles). Las pruebas de laboratorio deben realizarse con frecuencia y los resultados deben observarse de cerca.
3. Este medicamento puede causar disfunción hepática grave, como hepatitis fulminante. Debe controlarse la función hepática regular y observarse de cerca para detectar la disfunción hepática lo antes posible. Si se observa disfunción hepática temprana o fatiga junto con síntomas como pérdida de apetito, debe observarse de cerca. Si se encuentra ictericia (coloración amarilla de la esclerótica), suspenda el medicamento inmediatamente y tome las medidas apropiadas.
4. Este medicamento no debe combinarse con otros agentes antineoplásicos de fluorouracilo, regímenes de quimioterapia basados en fluorouracilo [como la quimioterapia combinada de leucovorina / tegafur-uracilo (UFT)], drogas antimicóticas fluorocitosina, etc. Conducir a reacciones adversas como disfunción hematopoyética grave (ver [interacciones farmacológicas]).
5. Este medicamento no debe combinarse con medicamentos antivirales como la selifudina o la brovudina, que pueden provocar reacciones adversas, como disfunción hematopoyética grave, y algunos pacientes pueden poner en peligro la vida (consulte [Interacciones farmacológicas] para más detalles).
6. Lea este manual detenidamente antes de usar este medicamento y cumpla estrictamente las normas de [Uso y dosificación].
[nombre de la droga]
Nombre genérico: cápsulas de Tiggio
Nombre del producto: Weikangda
Nombre en inglés: Tegafur, Gimeracil and Oteracil Potassium Capsules
Pinyin chino: Tiji'ao Jiaonang
[Ingredientes] Este producto es una preparación compuesta, los componentes principales son tegafur, gemcitabina y etiracil potasio.
【Propiedades】 Este producto es una cápsula dura, cuyo contenido es polvo o partículas blancas o blanquecinas.
[Indicaciones] Cáncer gástrico local avanzado o metastásico que no se puede extirpar.
[Especificaciones] (1) especificaciones de 20 mg: tegafur 20 mg, gemcitabina 5,8 mg y oltipraz potásico 19,6 mg.
(2) Especificación de 25 mg: 25 mg de tegafur, 7,25 mg de gemcitabina y 24,5 mg de oltipraz de potasio.
[Uso y dosificación]
Las cápsulas de Tiggio combinadas con cisplatino se usan para tratar pacientes no resecables con cáncer gástrico localmente avanzado o metastásico:
En general, la primera dosis de un adulto se determina de acuerdo con el área de superficie corporal de acuerdo con la siguiente tabla. El uso es 2 veces al día, oral después del desayuno y la cena, administración continua durante 28 días, descanso durante 14 días, para un ciclo de tratamiento. Dosificación hasta que la condición del paciente se deteriore o se vuelva intolerable.
Área de la superficie del cuerpo(㎡) | Primera dosis (basada en tegafur) |
<1.25 | 40mg cada vez |
≥1.25~<1.5 | 50mg cada vez |
≥1.5 | 60mg cada vez |
La cantidad de administración puede aumentarse o disminuirse dependiendo de la condición del paciente. Cada dosis se aumenta o disminuye secuencialmente en cuatro niveles de dosis de 40 mg, 50 mg, 60 mg y 75 mg. Si no ve la seguridad de las pruebas de laboratorio (rutina sanguínea, función hepática y renal) y los síntomas gastrointestinales causados por este medicamento, y el médico considera que es necesario aumentar el incremento, puede agregar un nivel de dosis según el orden anterior, el límite superior Es de 75 mg / hora. Si necesita reducir la cantidad, se reducirá de acuerdo con el nivel de dosis, y el límite inferior es de 40 mg / tiempo. Administración oral continua durante 21 días, descanso durante 14 días e infusión intravenosa de cisplatino 60 mg / m 2 en el octavo día de administración durante un ciclo de tratamiento. Dosificación hasta que la condición del paciente se deteriore o sea intolerable.
Uso y notas de uso:
1. Según la condición del paciente, la dosis puede aumentarse o disminuirse de acuerdo con los siguientes criterios, y el incremento no debe exceder un nivel de dosis en cada ciclo.
Reducción | Primera dosis | Incremento |
Dejar la droga | 40mg cada vez | 50mg cada vez |
Dejar la droga ← 40mg cada vez | 50mg cada vez | 60mg cada vez |
Dejar la droga ← 40mg cada vez←50mg cada vez | 60mg cada vez | 75mg cada vez |
2. Si necesita acortar el intervalo de quimioterapia, debe confirmar la seguridad de las pruebas de laboratorio (rutina sanguínea, función hepática y renal) y los síntomas gastrointestinales causados por este medicamento, pero el intervalo de quimioterapia no debe ser inferior a 7 días. No se ha confirmado la seguridad de acortar el intervalo de quimioterapia en pacientes con cáncer de mama inoperable o recurrente (sin experiencia clínica).
3. Para evitar reacciones adversas graves, como mielosupresión y hepatitis fulminante, se deben realizar pruebas de laboratorio (rutina sanguínea y función hepática y renal) antes de cada inicio de quimioterapia, y se debe observar minuciosamente el estado del paciente. Al menos una vez cada 2 semanas durante la quimioterapia, se debe realizar una prueba. . Si se encuentran anormalidades, se deben tomar las medidas apropiadas, como prolongar el intervalo de quimioterapia, reducir o suspender el medicamento de acuerdo con las regulaciones anteriores. La observación y el examen minuciosos se deben realizar en el primer ciclo o incremento del tratamiento (ver [Ensayo clínico] para más detalles).
4. La investigación básica (rata) descubrió que la medicación en ayunas puede cambiar la biodisponibilidad de oltipraz potasio, lo que conduce a su inhibición de la fosforilación de fluorouracilo, reduciendo así el efecto antitumoral del medicamento, por lo que debe tomarse después de las comidas.
Precauciones de uso del paciente:
Los pacientes deben prestar atención a la medicación:
Este medicamento es un blister de plástico de aluminio (PTP), se debe informar al paciente que el medicamento se debe sacar del blister antes de tomar el medicamento. Se ha informado que los pacientes toman erróneamente paneles de papel de aluminio, lo que provoca la perforación del esófago y provoca complicaciones graves, como la inflamación mediastínica.
【Reacciones adversas】
Primero, ensayos clínicos extranjeros:
Terapia combinada
Para pacientes con cáncer gástrico avanzado en Japón, compare el agente único de las cápsulas de Teggio (40-60 mg / hora de cápsulas de Teggio oral durante 28 días consecutivos, 2 veces al día, descanso 14 días) y las cápsulas de Tiglio combinadas con cisplatino. (Ensayos controlados aleatorios de fase III múltiples de cápsulas orales de Teggio para 40 a 60 mg / hora, 2 veces al día, cisplatino de 60 mg / m2 el día 8), y se evaluaron 298 pacientes con reacciones adversas. Las reacciones adversas se muestran en la tabla a continuación.
Reacciones adversas | Tasa de incidencia | |
Grupo de drogas individuales (n=150) | Grupo de tratamiento combinado (n=148) | |
Leucopenia (CTC ≥ 3 Grado) | 38%(2%) | 70%(11%) |
Reducción de neutrófilos (CTC ≥ 3 Grado) | 42%(11%) | 74%(40%) |
Anemia (CTC ≥ 3 Grado) | 33%(4%) | 68%(26%) |
Trombocitopenia (CTC ≥ 3 Grado) | 18%(0%) | 49%(5%) |
Pérdida de apetito (CTC ≥ 3 Grado) | 37%(6%) | 72%(30%) |
Asqueroso (CTC ≥ 3 Grado) | 26%(1%) | 67%(11%) |
Vómitos (CTC ≥ 3 Grado) | 14%(2%) | 36%(4%) |
Estomatitis (CTC ≥ 3 Grado) | 21%(0%) | 29%(0.7%) |
Diarrea (CTC ≥ 3 Grado) | 23%(3%) | 34%(4%) |
Débil (CTC ≥ 3 Grado) | 33%(1%) | 57%(4%) |
Pigmentación (CTC ≥ 3 Grado) | 40%(0%) | 36%(0%) |
Erupción (CTC ≥ 3 Grado) | 19%(1%) | 22%(2%) |
Lagrimas (CTC ≥ 3 Grado) | 16%(0.7%) | 18%(0%) |
En el último ensayo clínico de fase II del cáncer de pulmón de células no pequeñas combinado con quimioterapia (21 días de cápsulas de Teggio oral, 60 mg / m2 de cisplatino el día 8), se encontró que 55 pacientes con reacciones adversas tenían reacciones adversas, el principal adverso La reacción se muestra en la tabla a continuación.
Reacciones adversas | Terapia combinada |
Pacientes con cáncer de pulmón no microcítico (55 Ejemplo) | |
Tasa de incidencia (CTC ≥ 3 Grado)#4 | 100.0%(61.8%) |
Leucopenia(〈2000/mm³) | 52.7%(5.5%) |
Reducción de neutrófilos(〈1000/mm³) | 65.5%(29.1%) |
Reducción de la hemoglobina(〈8g/dl) | 90.9%(21.8%) |
Trombocitopenia(〈5×104/mm³) | 60.0%(1.8%) |
AST Elevar (GOT) | 14.5% |
ALT Elevar (GPT) | 14.5% |
Pérdida de apetito(CTC ≥ 3 Grado) | 78.2%(12.7%) |
Asqueroso(CTC ≥ 3 Grado) | 65.5%(10.9%) |
Vómitos(CTC ≥ 3 Grado) | 38.2%(7.3%) |
Diarrea(CTC ≥ 3 Grado) | 34.5%(7.3%) |
Estomatitis | 25.5% |
Pigmentación | 23.6% |
Erupción | 9.1% |
# 4: calificado según los criterios de evaluación de toxicidad común del American Cancer Institute.
2. Monoterapia
Entre los 578 pacientes que pudieron evaluar los eventos adversos (excluyendo los siguientes pacientes de mama, pancreáticos y colangiocarcinoma tratados previamente), la incidencia de eventos adversos fue del 87,2% (504 pacientes). En comparación con otros tipos de tumores, la incidencia de reacciones adversas en pacientes con cáncer de mama inoperable o recurrente, cáncer de páncreas y colangiocarcinoma que habían sido tratados con paclitaxel fue mayor, 96.4%, 98.3% y 94.9%, respectivamente. Los pacientes con cáncer de páncreas tienen una mayor incidencia de reacciones adversas, especialmente reacciones gastrointestinales como pérdida de apetito, náuseas, vómitos y diarrea. Cuando se usa un solo medicamento, las siguientes reacciones adversas son comunes:
Reacciones adversas | Monoterapia | ||||
Todos los pacientes (578 Ejemplo)#1 | Pacientes con cáncer de mama tratados previamente (55 Ejemplo) | Paciente con cáncer de páncreas (59 Ejemplo) | Colangiocarcinoma (59 Ejemplo) | ||
#1 | Paciente con cáncer gástrico (134 Ejemplo) | ||||
Tasa de incidencia (CTC≥3 Grado)#2 | 87.2%(22.5%) | 77.6%(20.9%) | 96.4%(30.9%) | 98.3%(42.4%) | 90.4%(30.5%) |
Leucopenia(〈2000/mm³) | 45.8%(2.8%) | 48.5%(3.7%) | 69.1%(9.1%) | 32.2%(0%) | 49.2%(3.4%) |
Reducción de neutrófilos(〈1000/mm³) | 43.9%(8.5%) | 47.8%(7.5%) | 72.7%(10.9%) | 27.1%(6.8%) | 42.4%(5.1%) |
Reducción de la hemoglobina(〈8g/dl) | 38.1%(5.7%) | 38.8%(7.5%) | 45.9%(3.6%) | 50.8%(5.1%) | 50.8%(6.8%) |
Trombocitopenia(〈5×104/mm³) | 10.9%(1.6%) | 9.0%(1.5%) | 38.2%(1.8%) | 33.9%(1.7%) | 23.7%(0%) |
AST Elevar (GPT) | 11.1% | 4.5% | 34.5% | 18.6% | 37.3% |
ALT Elevar (GPT) | 11.1% | 3.7% | 29.1% | 16.9% | 27.1% |
# 1: Incluye ensayos clínicos de registro multicéntrico de fase II para cáncer gástrico, cáncer colorrectal, cáncer de pulmón de células no pequeñas, cáncer de cabeza y cuello y cáncer de seno en Japón; excluyendo pacientes con colangiocarcinoma de seno, pancreático y colangio previamente tratados;
# 2: Utilice los Criterios de evaluación de toxicidad común del American Toxicological Institute o la clasificación de la Sociedad Japonesa de Oncología Clínica;
# 3: Incluye fatiga.
3. El tiempo de ocurrencia y el tiempo de recuperación de las reacciones adversas.
Análisis de 453 pacientes con cáncer gástrico, cáncer colorrectal, cáncer de cabeza y cuello, cáncer de pulmón de células no pequeñas (monoterapia), cáncer de mama inoperable o recurrente, cáncer de páncreas y colangiocarcinoma en el ensayo clínico de fase II tardío La reacción ocurre, y los resultados son los siguientes:
La mediana del tiempo requerido desde el inicio de la administración hasta el recuento de glóbulos blancos <3000 / mm3, el valor más bajo de hemoglobina <8g / dL, el recuento de plaquetas <7,5 × 104 / mm3 fue de 27 días, 25 días y 24 días, respectivamente. La mediana del tiempo requerido para confirmar la recuperación de los criterios anteriores fue de 7 días, 5,5 días y 6 días, respectivamente.
Valor anormal de prueba de laboratorio | Numero de ocurrencias | Tiempo hasta el valor más bajo: mediana (rango) | Número de casos de recuperación. | Tiempo de recuperación: valor medio (rango) |
Leukopenia | 92 Ejemplo | 27 Día (4-43 Día) | 85 Ejemplo | 7 Día (1-93 Día) |
Reducción de la hemoglobina | 29 Ejemplo | 25 Día (5-43 Día) | 24 Ejemplo | 5.5 Día(1-21 Día) |
Trombocitopenia | 28 Ejemplo | 24 Día (9-51 Día) | 25 Ejemplo | 6 Día (1-46 Día) |
Los valores medios de las reacciones adversas como diarrea, erupción cutánea y estomatitis asociadas con este medicamento desde la primera administración hasta el momento de las reacciones adversas fueron 24,5 días, 21 días y 28 días, respectivamente; las reacciones adversas anteriores fueron desde el nivel más grave hasta la recuperación. El tiempo medio requerido para la normalidad es de 9 días, 14 días y 13,5 días, respectivamente.
Síntoma | Numero de ocurrencias | Tiempo requerido para ocurrir: valor medio (rango) | Número de casos de recuperación. | Tiempo requerido para la recuperación: valor medio (rango) |
Diarrea | 100 Ejemplo | 24.5 Día (2-189 Día) | 95 Ejemplo | 9 Día (1-62 Día) |
Erupción | 67 Ejemplo | 21 Día (2-248 Día) | 63 Ejemplo | 14 Día (2-254 Día) |
Estomatitis | 100 Ejemplo | 28 Día (3-262 Día) | 94 Ejemplo | 13.5 Día (2-99 Día) |
4. Reacciones adversas en pacientes con función renal anormal.
La aplicación de medicamentos (cáncer gástrico) dentro de 1 año después de la lista de productos extranjeros se agrupa de acuerdo con la tasa de depuración de creatinina (estimación de Ccr) calculada por la fórmula de Cockcroft-Gault de acuerdo con el sexo, la edad, el peso corporal, el valor de creatinina sérica, etc. La incidencia de reacciones adversas es la siguiente: Mostrado La incidencia de reacciones adversas aumentó con la disminución de la tasa de depuración de creatinina, y aumentó la gravedad de las reacciones adversas. Los pacientes con dosis más bajas (un grado más bajo que la dosis estándar) tuvieron una menor incidencia de eventos adversos que los pacientes que recibieron la dosis estándar para la primera dosis.
Ccr estimar | La primera dosis es una dosis estándar del paciente. | Pacientes con dosis inicial más baja. | ||
Velocidad de reacción adversa | La incidencia de reacciones adversas graves (3 grados o más) | Velocidad de reacción adversa | La incidencia de reacciones adversas graves (3 grados o más) | |
<30 | 85.0% (17/20) | 65.0% (13/20) | 82.4% (14/17) | 35.3% (6/17) |
≥30~<50 | 84.1% (307/365) | 36.4% (133/365) | 76.0% (117/154) | 29.9% (46/154) |
≥50~<80 | 77.1% (1037/1345) | 25.9% (349/1345) | 66.1% (285/431) | 20.9% (90/431) |
≥80 | 72.5% (764/1054) | 20.4% (215/1054) | 64.7% (205/317) | 19.9% (63/317) |
Cockcroft-Gault:
Hombre:
(140-Edad)×Peso(kg)
Ccr=——————————————
72×Creatinina sérica(mg/dL)
Mujer:
(140-Edad)×Peso(kg)×0.85
Ccr=————————————————
72×Creatinina sérica(mg/dL)
5. Reacciones adversas importantes
1) Mielosupresión, anemia hemolítica: puede causar mielosupresión grave, como reducción de células sanguíneas enteras, neutropenia (síntomas: fiebre, dolor de garganta y malestar general), leucopenia, anemia y trombocitopenia (tasa de incidencia como se indicó anteriormente) y anemia hemolítica (La incidencia es desconocida) y debe observarse de cerca. Si se encuentra una anormalidad, se deben tomar las medidas necesarias, como suspender el medicamento.
2) Coagulación intravascular diseminada (DIC): debido a la posibilidad de DIC (0.4%), los pacientes deben ser monitoreados de cerca. Si se descubre que los exámenes hematológicos, como el recuento de plaquetas, el FDP sérico y el fibrinógeno plasmático, son anormales, se debe suspender el medicamento y tomar las medidas necesarias.
3) Disfunción hepática grave, como hepatitis fulminante (se desconoce la tasa de incidencia) (consulte [Advertencia] para más detalles).
4) Deshidratación: la deshidratación puede ocurrir debido a diarrea severa (se desconoce la incidencia) y debe observarse de cerca. Si se encuentran anormalidades, se debe suspender el medicamento y se deben tomar medidas apropiadas como la rehidratación.
5) Enteritis severa: puede ocurrir enteritis severa (0.5%) y debe observarse de cerca. Si tiene dolor abdominal intenso, diarrea y otros síntomas, debe dejar de tomar el medicamento y tomar las medidas adecuadas.
6) Neumonía intersticial *: puede ocurrir neumonía intersticial (0.3%) (síntomas tempranos: tos, falta de aliento, dificultad para respirar y fiebre) y debe observarse de cerca. Si se encuentra una anormalidad, se debe suspender el medicamento y administrar una radiografía de tórax y una hormona adrenocortical.
7) Estomatitis severa, úlceras del tracto digestivo, sangrado gastrointestinal y perforación del tracto digestivo: se puede presentar estomatitis severa (incidencia desconocida), úlcera digestiva (0.5%), sangrado gastrointestinal (0.3%) y perforación del tracto digestivo ( La incidencia es desconocida) y debe observarse de cerca. Si se encuentran anormalidades, se debe suspender el medicamento y se debe realizar un examen de rayos X abdominal según sea necesario, y se deben tomar las medidas apropiadas.
8) Insuficiencia renal aguda: puede producirse una enfermedad renal grave como la insuficiencia renal aguda (frecuencia incidental) y debe observarse de cerca. Si se encuentran anormalidades, suspenda el medicamento y tome las medidas apropiadas.
9) Síndrome de Steven-Johnson y necrosis epidérmica tóxica (síndrome de Lyell): el síndrome de Steven-Johnson y la necrosis epidérmica tóxica pueden ocurrir (se desconoce la incidencia) y deben observarse de cerca. Si se encuentran anormalidades, suspenda el medicamento y tome las medidas apropiadas.
10) anomalías del sistema neuropsiquiátrico, como leucoencefalopatía: puede producirse leucoencefalopatía (los síntomas principales son alteración de la conciencia, ataxia cerebelosa y síntomas de demencia), alteración de la conciencia, desorientación, letargo, pérdida de memoria, síntomas extrapiramidales , deben observarse de cerca las barreras del lenguaje, la cuadriplejia, las alteraciones de la marcha, la incontinencia urinaria o las alteraciones sensoriales (se desconocen las tasas incidentales). Si se presentan los síntomas anteriores, debe dejar de tomar el medicamento.
11) Pancreatitis aguda: puede ocurrir pancreatitis aguda (se desconoce la tasa de incidencia) y debe observarse de cerca. Si hay dolor abdominal o amilasa sérica elevada, suspenda el medicamento y tome las medidas apropiadas.
12) Rabdomiólisis: puede producirse rabdomiólisis (incidencia inesperada), los síntomas incluyen dolor muscular, debilidad, CK elevada y mioglobina elevada en sangre / orina. Suspenda el medicamento y tome las medidas adecuadas, y tenga cuidado para prevenir la rabdomiólisis. Causado por insuficiencia renal aguda.
13) Pérdida olfativa: puede producirse alteración olfativa (0.1%), pérdida olfatoria (tasa inexplicada) y se requiere una estrecha observación. Si se encuentran anormalidades, suspenda el medicamento y tome las medidas apropiadas.
* Estudios de la incidencia de neumonía intersticial y otras enfermedades pulmonares en pacientes con cáncer de pulmón no microcítico.
El uso de drogas en el cáncer de pulmón de células no pequeñas después de la comercialización de drogas mostró una incidencia de neumonía intersticial del 0,7% (11/1669), y la incidencia de otras enfermedades pulmonares, como neumonitis por radiación, disnea e insuficiencia respiratoria, fue del 0,7% (12 /). 1669).
6. Otras reacciones adversas
Pueden ocurrir las siguientes reacciones adversas: si se encuentran anormalidades, se deben tomar medidas apropiadas como la reducción o la abstinencia. Si el medicamento es alérgico, suspenda el medicamento y tome las medidas adecuadas. La incidencia del síndrome mano-pie fue mayor en pacientes con cáncer de mama previamente tratadas (21.8%). El estudio clínico del medicamento después del mercado encontró que la incidencia de lágrimas en pacientes con cáncer gástrico que no pudieron ser resecados o recaídos fue mayor (16.0%).
Clasificación Tasa de incidencia | Tasa de incidencia≥5% | 0.1% ≤ Tasa de incidencia < 5% | La incidencia es desconocida |
Hematología | Leucopenia, neutropenia, trombocitopenia, reducción de glóbulos rojos, reducción de hemoglobina, disminución del hematocrito, linfopenia | Tendencia hemorrágica (hemorragia subcutánea, secreción nasal, factores de coagulación sanguínea anormales, eosinofilia, leucocitosis) | |
Hígado | AST aumentado (GOT), ALT elevado (GPT), bilirrubina elevada, ALP elevada | Astrágalo, urinario biliar positivo |
La tasa de incidencia anterior se calcula en función de los resultados del ensayo clínico de un solo fármaco antes de que se apruebe el producto. 7, reacciones adversas, asuntos que requieren atención
(1) Se ha notificado leucemia aguda (en algunos casos con preleucemia) o síndrome mielodisplásico (SMD) en pacientes tratados con cápsulas de Teggio.
(2) Un número muy pequeño de pacientes carece de la enzima metabolizadora de fluorouracilo dihidropirimidina deshidrogenasa (DPD). Si se usa fluorouracilo, pueden producirse reacciones adversas graves (como estomatitis, diarrea, anomalías hematopoyéticas y nervios en la etapa inicial de administración). Enfermedad sistémica).
(3) Se encontró infarto cerebral, pero no se determinó la relación causal con la cápsula de Tiggio.
(4) El oltipraz de potasio se descompone fácilmente en un ambiente ácido fuerte (canino), mientras que la disminución de la concentración de oltipraz de potasio puede reducir su efecto inhibitorio en el tracto digestivo (rata), por lo que el valor del pH del estómago se reduce significativamente. Puede causar diarrea.
(5) Después de la administración repetida del perro, se encontraron la pigmentación de la esclera conjuntival y la nube corneal.
Segundo, ensayos clínicos nacionales:
Los resultados mostraron que la incidencia de reacciones adversas relacionadas con este producto fue del 83,78%, que fue principalmente del 68,47% del sistema sanguíneo (la incidencia de leucopenia fue del 45,05%, la incidencia de trombocitopenia fue del 20,72%, principalmente disminución de los grados I y II) , .8 46.85% (asqueroso, vómitos 39.64%, diarrea 7.21%), otros 14.41%. Este producto tiene una reacción adversa en el sistema sanguíneo comparable al tegafur, pero su respuesta del tracto digestivo es significativamente mejor que el tegafur.
La incidencia de eventos adversos relacionados con este producto fue de 2.70%, principalmente debido a hemorragia gastrointestinal leve y reducción de glóbulos rojos, y la incidencia fue menor que la de tegafur (3.48%).
[tabú]
1. Inhabilitado para pacientes con antecedentes de alergias graves a la composición de las cápsulas de Tiogio.
2. Los pacientes con mielosupresión severa están prohibidos (pueden exacerbar la mielosupresión).
3. Los pacientes con disfunción renal grave están prohibidos [Como resultado de los inhibidores de la enzima catabólica 5-FU: la disminución de la excreción urinaria puede causar un aumento en la concentración sanguínea de 5-FU, lo que agrava las reacciones adversas como la mielosupresión (ver [Farmacocinética]).
4. Los pacientes con disfunción hepática grave están prohibidos (pueden exacerbar la disfunción hepática).
5. Los pacientes que reciben otros tratamientos antineoplásicos con fluorouracilo (incluida la terapia de combinación) están prohibidos (ver [Interacciones farmacológicas] para más detalles).
6. Los pacientes que reciben terapia con fluorocitosina están prohibidos (ver [Interacciones farmacológicas] para más detalles).
7. Los pacientes que reciben tratamiento con solifedina y su análogo estructural (bromofina) están prohibidos (ver [Interacciones farmacológicas] para más detalles).
8. Las mujeres que están embarazadas o tienen un posible embarazo están prohibidas (ver [Mujeres embarazadas y mujeres lactantes]].
【Notas】
1. Usar con precaución [Los siguientes pacientes deben usar las cápsulas de Tegio con precaución]
(1) Pacientes con mielosupresión [pueden aumentar la mielosupresión];
(2) Pacientes con función renal anormal [Debido al inhibidor de la enzima catabólica 5-FU: la disminución de la excreción urinaria de citosina puede causar un aumento en la concentración sanguínea de 5-FU, lo que agrava las reacciones adversas como la mielosupresión (ver [ Farmacocinética]);
(3) Pacientes con función hepática anormal [pueden aumentar las anormalidades de la función hepática];
(4) Pacientes con enfermedades infecciosas [Las enfermedades infecciosas pueden agravarse por mielosupresión];
(5) Pacientes con tolerancia anormal a la glucosa [pueden aumentar la tolerancia anormal a la glucosa];
(6) Pacientes con antecedentes de neumonía intersticial o neumonía intersticial [pueden causar empeoramiento de los síntomas o progresión de la enfermedad];
(7) Pacientes con antecedentes de enfermedad cardíaca o enfermedad cardíaca [pueden agravar los síntomas];
(8) Pacientes con úlcera péptica o sangrado [pueden agravar los síntomas];
(9) pacientes de edad avanzada (ver [Uso geriátrico] para más detalles).
2) Consideraciones importantes
(1) Después de suspender el medicamento, si necesita tomar otros medicamentos antitumorales de fluorouracilo o medicamentos antimicóticos con flucitosina, debe tener un período de lavado de al menos 7 días (consulte [Interacciones farmacológicas] para más detalles).
(2) Después de que los otros agentes antineoplásicos de fluorouracilo o los medicamentos antimicóticos con fluorocitosina se desactivan, teniendo en cuenta los efectos de medicamentos anteriores, como el uso de cápsulas de Tiggio, debe haber un período de elución apropiado (consulte [Interacciones farmacológicas] para más detalles) )
(3) Se ha informado que los fluorouracilos combinados con el medicamento antiviral solifedina o brovudina pueden causar disfunción hematopoyética grave y pueden poner en peligro la vida de los pacientes. Por lo tanto, no lo use en combinación con Solifudine y sus análogos estructurales. Después de la interrupción de la solifedina y sus análogos estructurales, debe haber al menos un período de lavado de 56 días antes del uso de las cápsulas de Tiggio (ver [Interacciones farmacológicas]), teniendo en cuenta los efectos de los medicamentos anteriores.
(4) Se ha informado que los casos de enfermedades infecciosas graves causadas por mielosupresión (septicemia) causan la muerte debido a shock séptico y coagulación intravascular diseminada, por lo tanto, se debe prestar especial atención para evitar la aparición o agravamiento de la infección o tendencia a la hemorragia. .
(5) El uso de mujeres embarazadas debe tener en cuenta los posibles efectos de las gónadas.
(6) Este producto puede causar o agravar la neumonía intersticial, y los casos graves pueden causar la muerte. Por lo tanto, antes de administrar la cápsula de Tiggio, se examina al paciente para determinar si hay neumonía intersticial. Durante la administración, se debe observar de cerca al paciente para detectar síntomas como respiración, tos y fiebre, y se debe realizar una radiografía de tórax al mismo tiempo. Si se encuentra una anormalidad, suspenda el medicamento de inmediato y tome las medidas apropiadas. Los pacientes con cáncer de pulmón de células no pequeñas tienen más probabilidades de desarrollar enfermedad pulmonar, como la neumonía intersticial, que otros pacientes con cáncer (consulte [Reacciones adversas] para más detalles).
[Mujeres embarazadas y mujeres lactantes]
(1) Las mujeres que están embarazadas o que pueden tener un embarazo tienen prohibido tomar la cápsula de Tiggio. [Las mujeres embarazadas han desarrollado malformaciones neonatales después de tomar UFT. Además, se han encontrado efectos teratogénicos en estudios con animales (cápsulas orales continuas de tigeol (equivalentes a 7 mg / kg y 1,5 mg / kg de tegafur) en ratas y conejas preñadas han encontrado anomalías viscerales fetales, anomalías esqueléticas y osificación tardía) ]
(2) Las mujeres lactantes deben dejar de amamantar cuando toman cápsulas de Tiggio [No hay datos clínicos, pero los animales (ratas) han descubierto que las cápsulas de Tiggio pueden excretarse a través de la leche].
[Medicación para niños]
No se ha validado la seguridad de las cápsulas de tiggio en lactantes de bajo peso al nacer, recién nacidos, lactantes, niños pequeños y niños [no hay datos clínicos disponibles. Si un niño debe usar una cápsula de Tiggio, se debe considerar el efecto sobre la gónada, con especial atención a la aparición de reacciones adversas].
[Uso geriátrico] Debido a la disminución de la función fisiológica de los ancianos, este medicamento debe usarse con precaución.
[interacción farmacológica]
(1) Contraindicaciones para el uso de medicamentos (este producto no puede combinarse con los siguientes medicamentos)
Fármaco | Síntomas, signos y tratamiento. | Mecanismo y factores de riesgo. |
Agentes antineoplásicos de fluorouracilo: 5-FU, UFT, tegafur, desoxifluorouridina, capecitabina, carmofur; terapia combinada de leucovorina + UFT, terapia combinada de levo-folinato + fluorouracilo | La combinación de este tipo de fármaco (terapia) puede provocar disfunción hematopoyética grave y reacciones gastrointestinales como diarrea y estomatitis. No tome estos medicamentos durante al menos 7 días después de suspender la cápsula de Tiggio. Si se ha utilizado un medicamento de este tipo, para evitar sus efectos, debe haber un período de elución adecuado antes del inicio de la dosificación de la cápsula de Tiggio. | La gemcitabina contenida en la cápsula de Tiggio puede inhibir el fluorouracilo del uso combinado o el catabolismo del fluorouracilo producido por el medicamento, lo que resulta en un aumento significativo en la concentración de fluorouracilo (para más detalles, consulte [Farmacocinética]). |
Fluorouracilo antimicótico: flucitosina | ||
Solivudina y sus análogos estructurales como la brovudina. | Se ha descubierto que los fluorouracilos causan disfunción hematopoyética severa cuando se combinan con el fármaco antiviral solifedina o sus análogos estructurales como la brovudina, y algunos pacientes pueden ser potencialmente mortales. | El bromo-vinil uracilo (BVU), un metabolito de solifedina y bromivudina, inhibe irreversiblemente la dihidropirimidina deshidrogenasa, lo que resulta en un aumento en la concentración plasmática de 5-FU, un metabolito de la cápsula de Tiggio in vivo. |
(2) Precauciones para uso combinado (tenga en cuenta que este producto debe usarse junto con los siguientes medicamentos)
Fármaco | Síntomas, signos y tratamiento. | Mecanismo y factores de riesgo. |
Fenitoína | Puede producirse intoxicación por fenitoína (náuseas, vómitos, nistagmo y anomalías motoras), y debe observarse atentamente el estado general del paciente. Si se encuentran anormalidades, se deben tomar medidas apropiadas, como suspender el medicamento. | Tegafur inhibe el metabolismo de la fenitoína, lo que conduce a un aumento en la concentración plasmática de fenitoína. |
Warfarina Potasio | Puede mejorar el papel de la warfarina potásica, prestar atención a los cambios en la función de coagulación | El mecanismo de acción es desconocido. |
Otros medicamentos antineoplásicos o radioterapia. | Puede agravar reacciones adversas como la disfunción hematopoyética y las reacciones gastrointestinales. La condición del paciente debe observarse de cerca. Si se encuentran anormalidades, se deben tomar medidas apropiadas, como la reducción o la retirada. | Agravar las reacciones adversas entre sí. |
[Sobredosis de drogas] Una vez que se produce una sobredosis, debe ser estrechamente monitorizada y apoyada y sintomática. [Ensayo clínico] I. Resultados de ensayos clínicos extranjeros
(1) terapia combinada
LICORES: en un caso de 305 pacientes con cáncer gástrico avanzado en Japón, compare el fármaco único de la cápsula Teggio (en lo sucesivo, el grupo de fármaco único, la cápsula oral de Teggio de 40 a 60 mg / hora durante 28 días consecutivos, 2 veces al día, cada uno 6 semanas de repetitivo) y tibioplatino combinado con cisplatino (en adelante denominado el grupo de tratamiento combinado, cápsulas de Teggio oral de 40 a 60 mg / hora durante 21 días consecutivos, 2 veces al día, cisplatino 60 mg / m2 al octavo día, cada uno En un ensayo multicéntrico, aleatorizado y controlado de fase III de repeticiones de 5 semanas, el objetivo primario fue la supervivencia general (SG) y el resultado secundario fue la supervivencia libre de progresión (SLP) y la remisión tumoral. Las características basales de los pacientes en ambos grupos fueron equilibradas y comparables. Entre los 298 pacientes analizados, la mediana del tiempo de supervivencia fue de 13 meses y 11 meses en el grupo de tratamiento combinado (148 pacientes) y el grupo de un solo fármaco (150 pacientes), y la tasa de riesgo de supervivencia global fue de 0,77 (95% de confianza). Intervalo 0.61-0.98, prueba de rango logarítmico p = 0.04), el tratamiento combinado redujo el riesgo de muerte en aproximadamente un 23% en comparación con el grupo de monoterapia; la SLP media fue de 6 meses y 4 meses, respectivamente, y la razón de riesgo fue de 0.57. (Intervalo de confianza del 95% 0,44-0,73, prueba de rango logarítmico p <0,0001), en comparación con el grupo control, este producto / quimioterapia combinada con cisplatino puede reducir el riesgo de recurrencia en aproximadamente un 43%. Además, en 193 lesiones objetivo evaluables, las tasas de respuesta objetiva para los grupos de combinación y monoterapia fueron 54% (intervalo de confianza del 95% 43-65%) y 31% (intervalo de confianza del 95% 23-41%; Fisher) Prueba, p = 0,002).
SC-101:: Un estudio clínico aleatorizado, controlado y multicéntrico que involucró a 15 centros de investigación chinos.230 pacientes con cáncer gástrico avanzado fueron asignados al azar al grupo de monoterapia con Teggio (en adelante, el grupo de monoterapia, 80 pacientes, por vía oral durante 28 días consecutivos). Cápsulas de tiggio 40 ~ 60 mg / hora, 2 veces, repetidas cada 6 semanas), cápsula de tiggio combinada con el grupo de cisplatino (en adelante denominado el grupo de tratamiento combinado, 76 casos, cápsulas de Teggio oral 40 ~ 60 mg / tiempo durante 21 días consecutivos) 2 veces al día, cisplatino 60 mg / m2 en el octavo día, repetido cada 5 semanas) y fluorouracilo combinado con el grupo cisplatino (en lo sucesivo denominado el grupo control, 74 casos, infusión intravenosa de fluorouracilo 600 mg / m2 / día, cisplatino 20 mg / M2 / día, infusión intravenosa durante 30 minutos, dosificación en los días 1 a 5, repetida cada 4 semanas). Todos los pacientes deben ser administrados hasta que el tumor progrese o sea intolerable. Los pacientes que fallaron el tratamiento en el grupo de control pueden continuar recibiendo un tratamiento de segunda línea con tigeol. Las medidas de resultado primarias fueron las tasas de respuesta tumoral, y los resultados secundarios fueron la supervivencia total (SG) y el tiempo de fracaso del tratamiento (TTF). Las características demográficas basales de los tres grupos estaban bien equilibradas. El Comité de Evaluación Independiente evaluó los datos de imágenes de acuerdo con los criterios RECIST. Los resultados mostraron que entre los 224 pacientes, el grupo de tratamiento combinado (74 casos), el grupo de un solo fármaco (77 casos) y el grupo control (73 casos) tuvieron tasas de remisión tumoral de 37.8%, 24.7% y 19.2% fueron significativamente mejores en el grupo de combinación que en el grupo control (CMH, = P 0.021). En el grupo control, 41 pacientes recibieron el tratamiento de segunda línea con tiggio, y la tasa de remisión del tumor fue del 14.6%. . La mediana de SG del grupo de terapia de combinación, el grupo de monoterapia y el grupo de control fueron 433 días, 267 días y 309 días, respectivamente (el tiempo de supervivencia del grupo de control fue de 41 casos de fracaso del tratamiento y se transfirió al tratamiento de segunda línea de monoterapia con Teggio). Significativamente mejor que el grupo control (prueba de rango logarítmico, P = 0.038) y grupo de un solo fármaco (rango logarítmico, P <0.001); la mediana de TTF fue de 159 días, 126 días y 85 días, respectivamente, el grupo de tratamiento combinado fue significativamente mejor que Grupo de control (Log-rank, P <0.001) y grupo de fármaco único (Log-rank, P = 0.008).
(2) Tratamiento farmacológico único
Resumen Los resultados de los ensayos clínicos de las cápsulas de Tiggio oral (80-150 mg al día, calculadas como teflón) dos veces al día son efectivas en el cáncer gástrico. 5 46.5% (60/129). Los resultados incluyeron un ensayo temprano de fase II de quimioterapia de un solo fármaco para tumores gastrointestinales en Japón y dos ensayos clínicos tardíos de fase II para cáncer gástrico. Los detalles de cada prueba son los siguientes:
Ensayo de estadio II temprano: para el cáncer gástrico avanzado, cápsulas de teicofo oral de 50-75 mg / hora durante 28 días, dos veces al día, repetidas cada 6 semanas durante más de 2 ciclos. Se inscribieron un total de 31 pacientes y se evaluaron 28 pacientes con efecto curativo (incluidos 9 pacientes con retratamiento). La tasa de respuesta objetiva fue del 53,6% (15/28, intervalo de confianza del 90% 38,4-68,1%).
Ensayo clínico de fase II tardío (ensayo T de cáncer de estómago): para pacientes con cáncer gástrico avanzado, cápsulas de teicofo oral de 40 a 60 mg / hora durante 28 días consecutivos, dos veces al día, repetidas cada 6 semanas. Se incluyeron un total de 51 pacientes, todos los cuales fueron evaluables (incluidos los casos de evaluación de lesiones primarias), incluido 1 caso de remisión completa y 24 casos de remisión parcial. La tasa de respuesta objetiva fue del 49% (25/51, intervalo de confianza del 95% 35.9-62.3%). .
Ensayo clínico de fase II tardío (prueba de cáncer de estómago K): para pacientes con cáncer gástrico avanzado, cápsulas de teicofo oral de 40 a 60 mg / hora durante 28 días consecutivos, dos veces al día, repetidas cada 6 semanas. Se inscribieron un total de 51 pacientes, de los cuales se evaluaron 50 pacientes (incluidos los casos de evaluación de lesiones primarias), incluidos 20 pacientes con respuesta parcial, y la tasa de respuesta objetiva fue del 40,0% (20/50, intervalo de confianza del 95% 30,4-58,9%).
Segundo, resultados de ensayos clínicos nacionales.
1, método de prueba
Un total de 226 pacientes con cáncer gástrico avanzado se dividieron aleatoriamente en dos grupos, 111 en el grupo experimental y 115 en el grupo de control, utilizando un ensayo multicéntrico, aleatorizado, controlado con un fármaco positivo controlado en paralelo.
Grupo de prueba: cápsula oral de Tiggio 80 mg / m2 / día (administrada por superficie corporal), tomar 1 vez después del desayuno y después de la cena (la dosis diaria máxima no debe exceder los 150 mg), medicación continua durante 14 días, dejar de tomar el medicamento 1 semana es un ciclo; cisplatino: 75 mg / m2, infusión intravenosa (D1, 2, 3) en tres días, repetida durante tres semanas.
Grupo de control: Teflón oral 800 mg / m2 / d (administrado según el área de superficie corporal), tomado en 3 veces, medicación continua durante 14 días y una semana de abstinencia durante una semana. Cisplatino: 75 mg / m2, infusión intravenosa (D1, 2, 3) en tres días, repetida durante tres semanas. Cada grupo de pacientes fue tratado durante al menos 2 ciclos para la evaluación de la eficacia. Tales como CR, PR o SD pueden continuar el tratamiento hasta que la enfermedad progresa, la EP se cambia a otros regímenes de quimioterapia o radioterapia. CR y PR deben confirmarse después de cuatro semanas.
2, indicadores de observación
(1) Indicador de efectividad: tasa de remisión
(2) Indicadores de seguridad: pruebas de laboratorio, signos vitales y eventos adversos.
3, resultados de la prueba
La tasa efectiva del grupo experimental (CR + PR fue de .9 27.93%, el grupo fue de 7.83%. Entre ellos, la tasa efectiva del grupo de tratamiento inicial fue de 30.77%, el grupo de control fue de 10.91%; la tasa efectiva de los pacientes retirados fue de 25.42. %, el grupo control fue 5.00%.
【Farmacología y Toxicología】
Efectos farmacológicos:
1, efecto antitumoral
Tiggio inhibe el crecimiento de cáncer gástrico humano, cáncer colorrectal, cáncer de mama, cáncer de pulmón, cáncer de páncreas y cáncer renal en ratones desnudos (ratas y ratones), y prolonga el tiempo de supervivencia del cáncer de pulmón Lewis de ratón y el modelo de metástasis L5178Y.
2, el mecanismo de acción
La cápsula de Tiggio consiste en tegafur (FT), gemcitabina (CDHP) y oxilatino-potasio (Oxo). Su mecanismo de acción es: FT se convierte gradualmente en 5-fluorouracilo (5-FU) en el cuerpo después de la administración oral. El CDHP inhibe selectivamente de forma reversible la enzima catabólica 5-FU, DPD, presente en el hígado, aumentando así la concentración de 5-FU del FT. Junto con el aumento de la concentración de 5-FU en el cuerpo, el producto de fosforilación de 5-FU 5-fluoronucleótido en los tejidos tumorales puede mantener una alta concentración, mejorando así el efecto antitumoral. Oxo se distribuye en el tracto gastrointestinal después de la administración oral, y puede inhibir selectivamente de forma reversible la orotato de fosforibosiltransferasa, inhibiendo selectivamente la conversión de 5-FU en 5-fluoronucleótido, lo que no afecta la actividad antitumoral de 5-FU. Reduce los efectos secundarios gastrointestinales. El principal mecanismo de acción de 5-FU es unirse competitivamente a la timidina sintasa por sus metabolitos activos FdUMP y dUMP, y formar un trímero con folato reducido, inhibiendo así la síntesis de ADN. Además, el 5-FU se convierte en FUTP y se integra en las moléculas de ARN, lo que altera la función del ARN.
Investigación toxicológica:
La prueba de toxicidad aguda mostró que la DL50 de los ratones era de 441-551 mg / kg, y la LD50 de los perros Beagle era de 53 mg / kg. Los resultados de las pruebas de toxicidad a largo plazo muestran que este producto se administra por vía oral a ratas SD y perros Beagle durante 13 a 52 semanas. El principal órgano tóxico objetivo son las células madre hematopoyéticas de la médula ósea.
[Farmacocinética]
1. Farmacocinética
(1) concentración de sangre
Doce pacientes con cáncer recibieron una dosis oral única de 32-40 mg / m2 después de la comida. Los parámetros farmacocinéticos calculados de acuerdo con la concentración en sangre se muestran en la siguiente tabla:
Tabla 1 Parámetros farmacocinéticos (n = 12, media ± DE)
Cmax(ng/ml) | Tmax(hr) | AUC(0-48h) (ng•hr/ml) | T½(hr) | |
Tegafur | 1791.0±269.0 | 2.4±1.2 | 28216.9±7771.4 | 13.1±3.1 |
5-FU | 128.5±41.5 | 3.5±1.7 | 723.9±272.7 | 1.9±0.4 |
Gema pirimidina | 284.6±116.6 | 2.1±1.2 | 1372.2±573.7 | 3.0±0.5 |
Oteracil potasio | 78.0±58.2 | 2.3±1.1 | 365.7±248.6 | 3.0±1.4 |
Las tasas de excreción acumulada de los componentes en la orina dentro de las 72 horas fueron: gemcitabina 52.8%, tegafur 7.8%, oltipraz potasio 2.2%, metabolito ácido cianúrico 11.4%, 5-FU 7.4%.
Después de la administración oral de este producto a 25-200 mg / persona, los valores de AUC y la Cmáx de tegafur, gemcitabina, oltipraz potasio y 5-FU aumentaron de manera dependiente de la dosis. Dos veces al día, administración oral de 32 ~ 40 mg / m2 durante 28 días consecutivos, se midió la concentración en sangre los días 1, 7, 14 y 28, respectivamente, y los resultados mostraron que la concentración en sangre alcanzó un estado estacionario. Además, el uracilo endógeno disminuyó rápidamente después de la administración continua, lo que indica que el efecto inhibidor reversible del gimeracilo sobre la DPD aumentó.
(2) Las ratas se usaron solas o en combinación con otras fluoropirimidinas durante 7 días, y la concentración plasmática de 5-FU en plasma se midió 2 horas después de la última administración. Los resultados mostraron que la concentración de 5-FU después de la combinación con 5-FU, tegafur, tegafur-uracilo, carmofur, desoxifluorouridina y flucitosina fue 8.1 veces mayor que la del grupo de productos, 8.1 veces, 2.8 veces, 5.7 veces, 6.9 veces, 2.3 veces, lo que puede aumentar los efectos secundarios del grupo combinado.
(3) Los valores de AUC de pacientes con función renal normal e insuficiencia renal leve son los siguientes:
Tabla 2 Valores de AUC de cada componente después de la administración oral de este producto en pacientes con diferentes funciones renales (medios ± DE)
Ccr estimar | AUC(0-8hr) | |
>80ml/min(n=17) | 50ml~80ml/min(n=11) | |
Tegafur | 10060±1842 | 11320±2717 |
5-FU | 541.2±174.8 | 812.4±244.9 |
Gema pirimidina | 977.8327.9 | 1278.0±306.6 |
Oteracil potasio | 155.7±97.5 | 458.2±239.7 |
Note: Cockcroft-Gault formula:
Depuración de creatinina = (140 años) × peso corporal (kg) / (72 × valor de creatinina sérica (mg / dL)
(Para las mujeres, el valor anterior debe ser × 0.85)
2, unión a proteínas
Las pruebas in vitro mostraron que las tasas de unión de albúmina sérica de los componentes y 5-FU en la prescripción fueron: 49-50% para tegafur, 32-33% para gemcitabina, 7-10% para oltipraz potasio y 5-FU 17 -20%.
3. Enzimas metabolizantes
Las pruebas in vitro han demostrado que la enzima implicada en la conversión de tegafur a 5-FU es principalmente CYP2A6 en el citocromo microsómico hepático humano P450.
[Almacenamiento] sellado, almacenado a temperatura ambiente (10 ~ 30 ° C).
[Embalaje] envases de plástico de aluminio.
Especificación de 20 mg (basada en tegafur): 12 cápsulas / caja, 14 cápsulas / caja, 28 cápsulas / caja, 42 cápsulas / caja.
Especificación de 25 mg (en tegafur): 12 tabletas / caja, 24 / caja, 36 / caja.
[Período de validez] 24 meses
[Normas ejecutivas] Norma estatal de la Administración de Alimentos y Medicamentos YBH14202008
[Número de aprobación]
1, especificación de 20 mg (basada en tegafur): palabra estándar de medicina china H20080802
2, especificación de 25 mg (basada en tegafur): palabra estándar de medicina china H20080803
[Fabricante]
Nombre de la empresa: Shandong New Times Pharmaceutical Co., Ltd.
Dirección de producción: No. 1 North Outer Ring Road, Condado de Feixian, provincia de Shandong Código postal: 273400
Número de teléfono: 0539-8336336 (Ventas) 5030608 (Departamento de gestión de calidad)
Número de fax: 0539-5030900
Sitio web: www.LUNAN.com.cn
Línea directa de atención al cliente las 24 horas: 400-0539-310