Ácido zoledrónico inyectable
DescripciónFunción analítica completa < BR > Laboratorio de recubrimiento de película fina
Ácido zoledrónico inyectable.
Indicación
Dolor óseo causado por metástasis óseas osteolíticas de tumor maligno.
Farmacología clínica
La acción farmacológica del ácido zoledrónico es principalmente para inhibir la resorción ósea, y su mecanismo de acción no se comprende completamente y puede estar relacionado con varios efectos. El ácido zoledrónico inhibe la actividad de los osteoclastos, induce la apoptosis de los osteoclastos y bloquea la absorción de osteoclastos del hueso mineralizado y el cartílago al unirse al hueso. El ácido zoledrónico también inhibe la actividad de los osteoclastos y la liberación de calcio en los huesos causada por múltiples estímulos liberados por el tumor.
Uso y dosificación
Goteo intravenoso. Adultos cada vez 4 mg, diluidos con 100 ml de inyección de cloruro de sodio al 0,9% o inyección de glucosa al 5%, infusión intravenosa, el tiempo de infusión no debe ser inferior a 15 minutos. Dosificación cada 3 a 4 semanas o según las indicaciones de su médico.
Formulación
Aguja de polvo
Especificación
4 mg (calculado como C5H10N2O7P2).
Manual de instrucciones
Fecha de aprobación: 22 de abril de 2007
Fecha de revisión: 29 de agosto de 2014
Instrucciones para el ácido zoledrónico inyectable.
Lea atentamente las instrucciones y úselas bajo la guía de un médico.
[nombre de la droga]
Nombre genérico: ácido zoledrónico inyectable
Nombre del producto: en Lida
Nombre en inglés: Zoledronic Acid for Injection
Pinyin chino: Zhusheyong Zuolailinsuan
[Ingredientes] El componente principal de este producto es el ácido zoledrónico.
Nombre químico: [1-hidroxi-2- (1-imidazolil) etilideno difosfato monohidrato.
Estructura química:
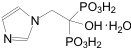
Fórmula molecular: C5H10N2O7P2 · H2O Peso molecular: 290.1
【Propiedades】 Este producto es una masa o polvo suelto blanco o blanquecino.
[Indicaciones] Dolor óseo causado por metástasis óseas osteolíticas de tumores malignos.
[Especificación] 4 mg (según C5H10N2O7P2).
[Uso y dosificación] goteo intravenoso. Adultos cada vez 4 mg, diluidos con 100 ml de inyección de cloruro de sodio al 0,9% o inyección de glucosa al 5%, infusión intravenosa, el tiempo de infusión no debe ser inferior a 15 minutos. Dosificación cada 3 a 4 semanas o según las indicaciones de su médico.
【Reacciones adversas】
La reacción adversa más común de este producto es la fiebre, y otras reacciones adversas incluyen principalmente:
Reacciones sistémicas: fatiga, dolor en el pecho, edema en las piernas, conjuntivitis;
Sistema digestivo: náuseas, vómitos, estreñimiento, diarrea, dolor abdominal, dificultad para tragar, anorexia;
Sistema cardiovascular: hipotensión;
Sistema sanguíneo y linfático: anemia, hipocalemia, hipomagnesemia, hipofosfatemia, hipocalcemia, neutropenia, trombocitopenia, reducción de células sanguíneas enteras;
Musculoesquelético: dolor óseo, dolor en las articulaciones, dolor muscular;
Riñón: niveles elevados de creatinina en suero (relacionado con el momento de la administración);
Sistema nervioso: insomnio, ansiedad, excitación, dolor de cabeza, somnolencia;
Sistema respiratorio: dificultad para respirar, tos, derrame pleural;
Infección: infección del tracto urinario, infección del tracto respiratorio superior;
Sistema metabólico: anorexia, pérdida de peso, deshidratación;
Otros: síntomas parecidos a la gripe; enrojecimiento, erupción cutánea, picazón, etc. en el sitio de inyección.
Los efectos secundarios tóxicos del ácido zoledrónico son principalmente leves y transitorios, y en la mayoría de los casos se resolverán automáticamente dentro de las 24 a 48 horas sin un tratamiento especial.
[tabú]
1. Pacientes discapacitados que son alérgicos a este producto y otros bisfosfonatos.
2, no se recomienda insuficiencia renal grave.
3. Las mujeres embarazadas y lactantes están prohibidas.
【Notas】
1. Cuando use este producto por primera vez, los niveles séricos de calcio, fósforo, magnesio y creatinina sérica deben controlarse de cerca. Si los niveles séricos de calcio, fósforo y magnesio son demasiado bajos, debe administrarse el tratamiento complementario necesario;
2, los pacientes con hipercalcemia maligna deben hidratarse adecuadamente antes de la administración de este producto, los diuréticos y este producto solo pueden usarse después de una hidratación adecuada, este producto debe usarse con el medicamento con nefrotoxicidad debe ser cauteloso;
3. Al recibir este producto, si hay un deterioro de la función renal, se debe suspender el medicamento hasta que la función renal vuelva al nivel basal;
4. Este producto debe usarse con precaución en pacientes con asma alérgicos a la aspirina.
[Mujeres embarazadas y mujeres lactantes]
No está claro si este producto se secretará a la leche, ya que este producto se puede combinar con hueso durante mucho tiempo, las mujeres embarazadas y las mujeres lactantes desactivan este producto.
[Medicación para niños]
La seguridad y eficacia de este producto en niños no se ha establecido y no se recomienda su uso.
[Uso geriátrico]
Usar con adultos. Sin embargo, los pacientes de edad avanzada a menudo tienen una función renal más baja, y la función renal debe ser monitoreada de cerca durante la administración del medicamento.
[interacción farmacológica]
Este producto debe usarse con aminoglucósidos en combinación, porque los aminoglucósidos tienen un efecto sinérgico de reducir el calcio en la sangre, lo que puede prolongar la duración de la hipocalcemia; cuando se combina con diuréticos, puede aumentar el riesgo de hipocalcemia; Cuando se combina con talidomida, aumenta el riesgo de disfunción renal en pacientes con mieloma múltiple.
【Sobredosis de drogas】
Los pacientes que reciben altas dosis de este producto pueden hacer que los niveles de calcio, fósforo y magnesio en el suero sean demasiado bajos, lo que puede complementarse con la administración intravenosa de gluconato de calcio, fosfato de potasio o sodio y sulfato de magnesio. Además, las dosis altas de este producto aumentan el riesgo de nefrotoxicidad. La dosis única de ácido zoledrónico no debe exceder los 4 mg.
【Farmacología y Toxicología】
Acción farmacológica
La acción farmacológica del ácido zoledrónico es principalmente para inhibir la resorción ósea, y su mecanismo de acción no se comprende completamente y puede estar relacionado con varios efectos. El ácido zoledrónico inhibe la actividad de los osteoclastos, induce la apoptosis de los osteoclastos y bloquea la absorción de osteoclastos del hueso mineralizado y el cartílago al unirse al hueso. El ácido zoledrónico también inhibe la actividad de los osteoclastos y la liberación de calcio en los huesos causada por múltiples estímulos liberados por el tumor.
Investigación toxicológica
Genotoxicidad:
El producto Ames prueba de mutación bacteriana posterior, prueba de aberración cromosómica de células de ovario de hámster chino, prueba de mutación genética de hámster chino y resultados de prueba de micronúcleos de rata fueron negativos.
Toxicidad para la reproducción:
Las ratas hembras fueron inyectadas por vía subcutánea con 0.01, 0.03 o 0.1 mg / kg / día (AUC por 0.07, 0.2 y 1.2 veces de 4 mg por vía intravenosa) desde el día 15 antes del apareamiento hasta el final del embarazo. El grupo de dosis alta mostró inhibición de la ovulación y La tasa de concepción se reduce. En los grupos de dosis media y alta, la pérdida de embriones antes de la implantación aumentó, la cantidad de embriones implantados y la cantidad de fetos vivos disminuyeron, y la tasa de supervivencia de las ratas recién nacidas disminuyó. La disentería y la mortalidad perinatal aumentaron en todos los grupos de dosis de madres. La causa de la muerte en la madre puede estar relacionada con la inhibición del fármaco de la movilización de calcio en los huesos, lo que lleva a la hipocalcemia perinatal, que puede ser un papel común para los bifosfonatos.
Las ratas hembras fueron inyectadas por vía subcutánea con 0.1, 0.2 o 0.4 mg / kg / día (AUC por 1.2, 2.4 o 4.8 veces cuando se administraron 4 mg por vía intravenosa), y los animales en dosis medias y altas fueron preimplantados o posimplantados. Aumento de la pérdida, reducción del número de nacimientos vivos, huesos fetales, órganos internos y deformidades en la apariencia. Las malformaciones esqueléticas de las camadas de animales en dosis altas no mostraron osificación ni osificación, engrosamiento, flexión o acortamiento de los huesos. En el grupo de dosis altas, también hubo reacciones tóxicas como contracción del cristalino, hipoplasia cerebelosa, contracción o pérdida lobular hepática, deformación de la hoja pulmonar, vasodilatación, paladar hendido y edema. Las malformaciones esqueléticas también ocurren en animales con dosis bajas. En este ensayo, los animales maternos en el grupo de dosis altas mostraron una disminución en el peso corporal y la ingesta de alimentos, lo que sugiere que el ensayo ha alcanzado el nivel más alto de exposición al fármaco.
Las conejas preñadas se administraron por vía subcutánea 0.01, 0.03, 0.1 mg / kg / día (el AUC fue menor o igual a 0.5 veces el de 4 mg por vía intravenosa), y no se observó toxicidad del producto a la camada. La muerte materna y el aborto ocurrieron en los animales de cada grupo de drogas (convertido a la superficie relativa del cuerpo y la dosis fue mayor o igual a 0.05 veces la dosis de 4 mg de droga intravenosa humana). Este fenómeno puede estar relacionado con la hipocalcemia causada por las drogas.
Carcinogenicidad:
Se realizaron estudios de carcinogenicidad convencionales de por vida con ratones y ratas. Los ratones se administraron por vía oral con 0.1, 0.5, 2.0 mg / kg / día (según el área de superficie corporal relativa, la dosis fue mayor o igual a 0.002 veces la cantidad de fármaco intravenoso humano 4 mg), y todos los animales del grupo eran adenomas de Harder. La incidencia ha aumentado. Las ratas se administraron por vía oral 0.1, 0.5, 2.0 mg / kg / día (convertidas al área relativa de la superficie corporal, la dosis fue menor o igual a 0.2 veces la cantidad de 4 mg de fármaco intravenoso humano), y no se observó aumento en la incidencia de tumores.
[Farmacocinética]
Distribución
64 pacientes con cáncer y metástasis óseas recibieron una dosis única o dosis múltiples (4 veces durante 28 días) 2, 4, 8 o 16 mg, y el tiempo de infusión fue de 5 o 15 minutos. La concentración de ácido zoledrónico en el plasma disminuyó después de la instilación. En el proceso de eliminación trifásico, la concentración de caída disminuye rápidamente desde el valor de concentración máxima, y la concentración de fármaco en sangre es inferior al 1% de la Cmáx después de 24 horas. La vida media de las dos primeras fases fue de 0.25 horas para t1 / 2α y 1.87 horas para t1 / 2β. La fase final del ácido zoledrónico se eliminó durante un período de tiempo más largo y permaneció baja en plasma durante 2 a 28 días después de la instilación. La vida media de eliminación final t1 / 2γ fue de 146 horas, y el área bajo la curva de concentración de fármaco-tiempo (AUC0-24h) en plasma fue proporcional a la dosis administrada en el rango de 2-16 mg. La tasa de acumulación de ácido zoledrónico en las tres fases fue baja, y las relaciones de los valores promedio de AUC0-24h de las dos fases 3 a la primera fase fueron 1.13 ± 0.30 y 1.16 ± 0.36, respectivamente. Las pruebas in vivo e in vitro mostraron que la afinidad del ácido zoledrónico con las células sanguíneas humanas era baja, y la tasa de unión a la proteína plasmática humana era de aproximadamente el 22%, y la tasa de unión era independiente de la concentración.
2. Metabolismo
Las pruebas in vitro mostraron que el ácido zoledrónico no tenía efecto inhibitorio sobre la enzima P450 humana, y el ácido zoledrónico no se biotransformaba in vivo, y el riñón lo excretaba en su forma original.
Excreción
La tasa promedio de recuperación de orina en 64 pacientes dentro de las 24 horas después de la administración de ácido zoledrónico fue del 39 ± 16%. Solo se encontró la cantidad traza del medicamento en la orina el segundo día después de la administración, y la orina se administró dentro de 0-24 horas. La tasa de porcentaje de excreción acumulativa no tiene nada que ver con la concentración del fármaco. La recuperación del fármaco en la orina no alcanza el equilibrio en 0 ~ 24 horas. Se especula que el fármaco se une primero al hueso y luego se libera lentamente en la circulación sistémica, de modo que el plasma observado a largo plazo es muy largo. El fenómeno de baja concentración de drogas. La tasa de eliminación renal del ácido zoledrónico fue de 3.7 ± 2.0 L / h dentro de 0 a 24 horas después de la administración, y el aclaramiento del ácido zoledrónico fue dependiente de la dosis y dependiente del aclaramiento de creatinina. En un estudio, el tiempo de infusión de 4 mg de ácido zoledrónico en pacientes con cáncer y metástasis óseas se extendió de 5 minutos (n = 5) a 15 minutos (n = 7), lo que resultó en la concentración de ácido zoledrónico al final del goteo. Una disminución interanual del 34% ([media ± DE] 403 ± 118 ng / ml frente a 264 ± 86 ng / ml), el valor total del AUC aumentó en un 10% (378 ± 116 ng × h / ml frente a 420 ± 218 ng × h / ml) La diferencia en los valores de AUC no fue estadísticamente significativa.
[Almacenamiento] sellado y almacenado.
[Paquete] vial, 1 botella / caja.
[Período de validez] 18 meses.
[Normas ejecutivas] National Food and Drug Administration National Drug Standard YBH21602004-2014Z
[Aprobación No.] Norma Nacional de Drogas H20041979
[Fabricante]
Nombre de la empresa: Shandong New Times Pharmaceutical Co., Ltd.
Dirección de producción: No. 1 North Outer Ring, Feixian County, Shandong Province
Código postal: 273400
Número de teléfono: 0539-8336336 (Ventas) 5030608 (Departamento de gestión de calidad)
Número de fax: 0539-5030900
Sitio web: www.LUNAN.com.cn
Línea directa de atención al cliente las 24 horas: 400-0539-310
