
Tabletas dispersables de azitromicina
DescripciónFunción analítica completa < BR > Laboratorio de recubrimiento de película fina
Tabletas dispersables de azitromicina
Indicación
Infecciones del tracto superior como otitis media, sinusitis, faringitis, amigdalitis; infecciones del tracto respiratorio inferior como bronquitis y neumonía. Infecciones de piel y tejidos blandos; infecciones genitales simples causadas por Chlamydia trachomatis; infecciones genitales simples causadas por bacterias gonocócicas no resistentes a múltiples fármacos (infección recombinante de melphalan spp.).
Farmacología clínica
La azitromicina es un antibiótico azalida cuyo mecanismo de acción es interferir con la síntesis de su proteína (sin afectar la síntesis de ácidos nucleicos) al unirse a la subunidad del ribosoma 50 de microorganismos sensibles. Los estudios in vitro y clínicos han demostrado que la azitromicina tiene efectos antibacterianos contra una variedad de bacterias patógenas: microorganismos aerobios grampositivos: Staphylococcus aureus, Streptococcus pyogenes, Streptococcus pneumoniae, Streptococcus hemolyticus. La azitromicina es resistente a las bacterias grampositivas resistentes a la eritromicina. La mayoría de Streptococcus faecalis (Enterococcus) y Staphylococcus resistente a la meticilina son resistentes a este producto. Microorganismos aerobios gramnegativos: Haemophilus influenzae, Moraxella catarrhalis, Mycoplasma trachomatis. Los estudios in vitro y clínicos han confirmado que la azitromicina puede prevenir enfermedades causadas por el complejo intracelular de Mycobacterium (compuesto por Mycobacterium avium y Mycobacterium intracellulare). La azitromicina es ineficaz contra las cepas que producen beta-lactamasa. Los estudios han demostrado que la azitromicina tiene un efecto antibacteriano in vitro en los siguientes microorganismos, pero su importancia clínica aún no está clara, incluidos Streptococcus (C, F, G), Streptococcus mutans, Bordetella pertussis, Haemophilus ducrei, Legionella pneumophila , Bacteroides, Streptococcus pneumoniae, Borrelia, Chlamydia pneumoniae, Treponema pallidum, Ureaplasma urealyticum y similares.
Uso y dosificación
Este producto puede tragarse directamente con agua o ponerse en una cantidad adecuada de agua tibia y revolver bien antes de tomarlo (consulte las instrucciones para más detalles).
Formulación
Película dispersable
Especificación
0,25 g
Manual de instrucciones
Fecha aprobada 8 de mayo de 2007
Fecha de revisión 1 de octubre de 2010
11 de diciembre de 2013 2015-11-25 aumentar las especificaciones de embalaje
Tableta dispersable de azitromicina
Lea atentamente las instrucciones y úselas bajo la guía de un médico.
[nombre de la droga]
Nombre genérico: tabletas dispersables de azitromicina
Nombre del producto: Jun Jie
Nombre en inglés: Azithromycin Dispersible Tablets
Pinyin chino: Aqimeisu Fensanpian
[Ingredientes] El ingrediente principal de este producto es la azitromicina.
Nombre químico: (2R, 3S, 4R, 5R, 8R, 10R, 11R, 12S, 13S, 14R) -13 - [(2,6-didesoxi-3-C-metil-3-O-metil- α-L-nuclear-hexiranosil) oxi] -2-etil-3,4,10-trihidroxi-3,5,6,8,10,12,14-heptametil-11- [ [3,4,6, -Trideoxi-3- (dimetilamino) -β-D-madera-piranosil] oxi] -1-oxa-6-azaciclopentadecano-15ona .
Estructura química:
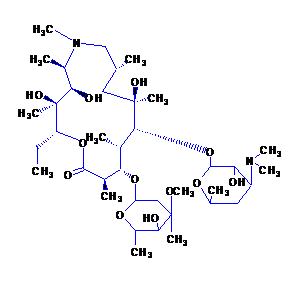
Fórmula molecular: C38H72N2O12
Peso molecular: 749.00
【Propiedades】 Este producto es blanco o blanquecino.
[Indicaciones] Este producto es adecuado para las siguientes infecciones causadas por bacterias sensibles:
Infecciones del tracto superior como otitis media, sinusitis, faringitis, amigdalitis; infecciones del tracto respiratorio inferior como bronquitis y neumonía. Infecciones de piel y tejidos blandos; infecciones genitales simples causadas por Chlamydia trachomatis; infecciones genitales simples causadas por bacterias gonocócicas no resistentes a múltiples fármacos (infección recombinante de melphalan spp.).
【Especificación】 0.25g
[Uso y dosificación] Las tabletas de azitromicina para el tratamiento de enfermedades infecciosas, el curso del tratamiento y el uso son los siguientes:
Este producto puede tragarse directamente con agua o ponerse en una cantidad adecuada de agua tibia y mezclar bien antes de tomarlo.
Adulto: las enfermedades de transmisión sexual causadas por Chlamydia trachomatis o bacterias gonocócicas sensibles, solo necesitan tomar 1.0 g (4 tabletas) de este producto en una sola dosis.
Tratamiento de otras infecciones: la dosis total es de 1,5 g (6 tabletas), dividida en tres dosis, 0,5 g (2 tabletas) de este producto una vez al día. O la dosis total es la misma, todavía 1.5 g (6 tabletas), tome 0.5 g (2 tabletas) el primer día, y luego tome 0.25 g (1 tableta) de este producto una vez al día durante el segundo al quinto día.
【Reacciones adversas】
(1) Experiencia en ensayos clínicos
Dado que los ensayos clínicos se realizan en diferentes condiciones, la tasa de reacción adversa de un fármaco observada en los ensayos clínicos no se puede comparar directamente con las tasas de reacción adversa de otros fármacos en los ensayos clínicos, y puede no reflejar reacciones adversas en aplicaciones prácticas. Tasa.
En el ensayo clínico de preparación intravenosa de azitromicina para la neumonía adquirida en la comunidad, se administraron de 2 a 5 dosis por vía intravenosa, y la mayoría de las reacciones adversas notificadas fueron de leves a moderadas, y se recuperaron después de suspender el medicamento. La mayoría de los pacientes en estos ensayos clínicos tienen más de una comorbilidad y necesitan aplicar otros medicamentos. Alrededor del 1.2% de los pacientes que recibieron inyecciones intravenosas de este producto descontinuaron la medicación, y el 2.4% de los pacientes tratados con azitromicina intravenosa u oral descontinuaron la medicación debido a síntomas de reacciones adversas o pruebas de laboratorio anormales.
En ensayos clínicos en pacientes con enfermedad inflamatoria pélvica, el 2% de los pacientes que recibieron monoterapia con azitromicina recibieron administración intravenosa del fármaco, el 2% de los pacientes interrumpieron debido a reacciones adversas clínicas, y los pacientes con azitromicina y metronidazol. El 4% de los pacientes interrumpieron el tratamiento debido a reacciones adversas.
En los estudios anteriores, las reacciones adversas más comunes que condujeron a la interrupción del medicamento fueron reacciones gastrointestinales (dolor abdominal, náuseas, vómitos, diarrea, etc.) y erupciones cutáneas, lo que condujo a pruebas de laboratorio anormales para la interrupción de la aminotransferasa y / o la fosfatasa alcalina. Alto.
En el estudio de neumonía adquirida en la comunidad, la reacción adversa más común en pacientes adultos que recibieron preparaciones intravenosas / orales fue reacciones gastrointestinales, incluyendo diarrea o heces blandas (4,3%), náuseas (3,9%) y dolor abdominal (2,7). %), vómitos (1,4%). Alrededor del 12% de los pacientes tuvieron reacciones adversas relacionadas con la inyección intravenosa, siendo el dolor más común en el lugar de la inyección (6.5%) y la respuesta inflamatoria local (3.1%).
En ensayos clínicos de pacientes con enfermedad inflamatoria pélvica, las mujeres adultas reciben preparaciones intravenosas / orales de este producto. Las reacciones adversas más comunes asociadas con el tratamiento son reacciones gastrointestinales, entre las cuales son frecuentes la diarrea (8.5%) y las náuseas (6.6). %), seguido de vaginitis (2.8%), dolor abdominal (1.9%), anorexia (1.9%), erupción cutánea y picazón (1.9%). En estos estudios, se produjo una combinación de azitromicina y metronidazol en una mayor proporción de pacientes femeninas con náuseas (10.3%), dolor abdominal (3.7%), vómitos (2.8%), lugar de administración, estomatitis, mareos y dificultad para respirar. 1,9%).
Otras reacciones adversas causadas por el régimen multidosis intravenoso / oral de azitromicina no superaron el 1%.
Las reacciones adversas con una incidencia de no más del 1% son:
Reacciones gastrointestinales: indigestión, distensión abdominal, mucositis, candidiasis oral y gastritis.
Sistema nervioso: dolor de cabeza, letargo.
Reacción alérgica: broncoespasmo.
Sensación especial: el sabor es incorrecto.
(II) Experiencia después de la aplicación después del listado
Las preparaciones orales de azitromicina se usan en pacientes adultos y / o niños después de la comercialización, y hay informes de los siguientes eventos adversos, pero no es seguro si es causada por azitromicina:
Alergias: dolor en las articulaciones, edema, urticaria, angioedema.
Cardiovascular: las arritmias incluyen taquicardia ventricular, hipotensión, prolongación rara del intervalo QT y taquicardia ventricular torsades de point.
Tracto gastrointestinal: anorexia, estreñimiento, indigestión, hinchazón, vómitos / diarrea, pero rara vez causa deshidratación, colitis pseudomembranosa, pancreatitis, candidiasis oral, estenosis pilórica y decoloración rara de la lengua.
Reacciones sistémicas: fatiga, parestesia, fatiga, molestias y respuesta al shock anafiláctico.
Sistema genitourinario: nefritis intersticial, insuficiencia renal aguda, vaginitis.
Sistema hematopoyético: trombocitopenia.
Hígado / biliar: Se han informado los efectos adversos asociados con la disfunción hepática en la experiencia de azitromicina después de la comercialización.
Sistema nervioso: convulsiones, mareos / vértigo, dolor de cabeza, letargo, hiperactividad, nerviosismo, agitación y síncope.
Oídos anormales y pérdida: sordera, tinnitus, pérdida de audición, mareos.
Espíritu: reacciones agresivas y ansiedad.
Piel y accesorios: picazón, una reacción cutánea rara y grave que incluye eritema multiforme, síndrome de Stevens Johnson y necrosis epidérmica tóxica.
Sentido especial: La discapacidad auditiva incluye pérdida de audición, sordera y / o tinnitus, así como informes de anormalidades y / o pérdida del gusto / olfativo.
Control de laboratorio anormalidades:
Las pruebas de laboratorio significativas (relacionadas o no con medicamentos) observadas en ensayos clínicos son:
La tasa de incidencia es del 4% al 6%: alanina aminotransferasa (ALT), aspartato aminotransferasa (AST) y creatinina.
La tasa de incidencia es del 1% al 3%: la lactato deshidrogenasa (LDH) y la bilirrubina están elevadas.
La incidencia es inferior al 1%: leucopenia, neutropenia, disminución del recuento de plaquetas y elevación de la fosfatasa alcalina sérica.
El seguimiento encontró que las anormalidades de laboratorio anteriores eran reversibles.
En un ensayo clínico de dosis múltiples de azitromicina (intravenosa / oral) en más de 750 pacientes, no más del 2% de los pacientes descontinuaron la azitromicina debido a anomalías en las enzimas hepáticas relacionadas con el tratamiento.
[tabú]
Se sabe que está prohibido en pacientes alérgicos a la azitromicina, la eritromicina, otros macrólidos o cetólidos. Los pacientes con antecedentes de ictericia colestática / disfunción hepática después del uso de azitromicina fueron previamente prohibidos.
Advertencia
Reacción alérgica
Los informes de reacciones alérgicas graves, que incluyen angioedema, shock anafiláctico y reacciones cutáneas, incluido el síndrome de Stevens Johnson y la necrólisis epidérmica tóxica, son poco frecuentes en el tratamiento con azitromicina. Aunque es raro, hay informes de muerte. En algunos pacientes, los síntomas alérgicos reciben inicialmente un tratamiento sintomático. Si el tratamiento se suspende prematuramente, incluso si no se usa azitromicina, los síntomas alérgicos pueden reaparecer rápidamente. Es necesario extender el tiempo para el tratamiento sintomático y la observación de dichos pacientes. No se sabe si la ocurrencia de estos eventos está relacionada con la larga vida media de azitromicina en el tejido y la mayor exposición del cuerpo al antígeno.
En el caso de una reacción alérgica, el medicamento debe suspenderse de inmediato y recibir el tratamiento adecuado. El médico debe saber que los síntomas alérgicos pueden reaparecer después de suspender el tratamiento sintomático.
Hepatotoxicidad
Ha habido informes de función hepática anormal, hepatitis, colestasis de ictericia, necrosis hepática e insuficiencia hepática, algunos de los cuales pueden ser fatales. Si aparecen síntomas y signos de hepatitis, deje de usar este producto inmediatamente.
Diarrea asociada a Clostridium difficile
Casi todos los medicamentos antibacterianos tienen informes de diarrea asociada a Clostridium difficile (CDAD), incluido este producto, que puede ir desde diarrea leve hasta colitis mortal. El tratamiento antimicrobiano puede causar cambios en la flora normal del colon, lo que lleva a una reproducción excesiva de Clostridium difficile.
La toxina A y la toxina B producidas por Clostridium difficile están asociadas con la patogénesis de CDAD. El C. difficile altamente tóxico causa una mayor morbilidad y mortalidad, y estas infecciones pueden ser difíciles de tratar con antibióticos y pueden requerir colectomía. Para todos los pacientes con diarrea después de usar antibióticos, se debe considerar la posibilidad de CDAD. Dado que ha habido informes de CDAD después de más de 2 meses de tratamiento con antibióticos, es necesario preguntar cuidadosamente sobre el historial médico.
Si se sospecha o se diagnostica el CDAD, puede ser necesario suspender el antibiótico que no se usa para Clostridium difficile. El agua, los electrolitos y las proteínas deben complementarse adecuadamente de acuerdo con las necesidades clínicas, y deben administrarse antibióticos que sean efectivos contra Clostridium difficile, y debe realizarse una evaluación quirúrgica si es necesario.
【Notas】
General: Debido a que la azitromicina es eliminada principalmente por el hígado, los pacientes con insuficiencia hepática deben usar azitromicina con precaución. Los sujetos con una TFG <10 ml / min tienen datos limitados, y la azitromicina debe usarse con precaución en tales pacientes. Ha habido informes de función hepática anormal, hepatitis, ictericia colestática, necrosis hepática e insuficiencia hepática, algunos de los cuales pueden ser fatales. Si hay signos y síntomas de hepatitis, la azitromicina debe suspenderse de inmediato.
Extensión de intervalo QT
Se ha informado que el uso de otros antibióticos macrólidos, incluida la azitromicina, puede causar repolarización ventricular y la prolongación del intervalo QT, lo que conlleva el riesgo de arritmia y taquicardia ventricular torsade. En la vigilancia posterior a la comercialización de pacientes que tomaban azitromicina, hubo un informe espontáneo de un caso de taquicardia ventricular torsades de pointes. Al sopesar los riesgos y beneficios del uso de azitromicina en poblaciones de alto riesgo, los proveedores de atención médica deben considerar el riesgo de una prolongación del intervalo QT potencialmente fatal, que incluye:
· Se conocen pacientes con intervalo QT prolongado, taquicardia ventricular torsada toxoplásmica, síndrome de prolongación QT congénito, bradiarritmia o insuficiencia cardíaca descompensada.
· Pacientes que se sabe que prolongan sus medicamentos con intervalo QT, como antipsicóticos, antidepresivos y fluoroquinolonas.
· Pacientes con arritmia, como hipocalemia o hipomagnesemia no corregida, bradicardia clínicamente significativa y que reciben tipo IA (quinidina, procainamida) y tipo III ( Pacientes con medicamentos antiarrítmicos como dofetilida, amiodarona y sotalol.
·Pacientes de edad avanzada: los pacientes de edad avanzada pueden ser más sensibles a los efectos del intervalo QT relacionado con el fármaco.
Los pacientes tratados con azitromicina han informado agravamiento de la miastenia gravis o un nuevo síndrome de miastenia gravis.
En ausencia de un diagnóstico o un alto grado de sospecha de infección bacteriana, o sin indicación de prevención, el uso de este producto puede no ser beneficioso para el paciente y aumentará el riesgo de bacterias resistentes a los medicamentos.
Los pacientes necesitan saber:
La azitromicina debe suspenderse inmediatamente cuando se presenten signos de reacciones alérgicas y contacte a su médico.
Se debe informar a los pacientes que los antibióticos que incluyen este producto (azitromicina) solo se pueden usar para tratar infecciones bacterianas y no se pueden usar para tratar infecciones virales (por ejemplo, el resfriado común). Cuando se usa este producto (azimicina) para tratar infecciones bacterianas, se debe informar a los pacientes que, aunque generalmente se sienten mejor al comienzo del tratamiento, deben seguir las instrucciones del médico para obtener una medicación precisa. Perder o no completar todo el curso del tratamiento puede: (1) reducir la eficacia de los tratamientos actuales; (2) aumentar la posibilidad de resistencia bacteriana, lo que conducirá a la incapacidad de la azitromicina u otros antibióticos para tratar estas bacterias resistentes en el futuro.
El tratamiento con antibióticos a menudo causa diarrea, que generalmente se recupera después de suspender el antibiótico. A veces, después del tratamiento con antibióticos, el paciente puede tener heces acuosas o heces con sangre (con o sin calambres estomacales y fiebre) 2 meses o más después del último uso de antibióticos. Si esto sucede, el paciente debe contactar al médico lo antes posible.
[Mujeres embarazadas y mujeres lactantes]
Los estudios de toxicidad reproductiva en animales han demostrado que la azitromicina atraviesa la placenta pero no muestra signos de daño a la camada. No hay datos de secreción de este producto en la leche materna. Los datos de pruebas en animales no predicen completamente la aplicación de humanos. La seguridad de uso en el embarazo y la lactancia no se ha confirmado hasta ahora, por lo que este producto no debe usarse cuando no hay una opción adecuada para mujeres embarazadas o lactantes.
[Medicamentos para niños] Este experimento no se realizó y no hay una referencia confiable.
[Uso geriátrico] Este experimento no se realizó y no hay una referencia confiable.
[interacción farmacológica]
Interacciones farmacológicas: la administración oral de una dosis única de azitromicina en el estado estacionario de nelfinavir puede aumentar la concentración sérica de azitromicina. Aunque no es necesario ajustar la dosis de azitromicina cuando se usa en combinación con nelfinavir, los efectos secundarios conocidos de la azitromicina, como las anormalidades de las enzimas hepáticas y la discapacidad auditiva, deben controlarse de cerca.
Los informes espontáneos posteriores a la comercialización sugieren que el uso combinado de azitromicina puede aumentar los efectos de los anticoagulantes orales. Cuando los pacientes se combinan con azitromicina y anticoagulantes orales, el tiempo de protrombina se debe controlar de cerca.
A una dosis terapéutica, azitromicina versus atorvastatina, carbamazepina, cetirizina, didanosina, efavirenz, fluconazol, indinavir, midazolam, rifabutina, oeste La farmacocinética de dipiridamol, teofilina (administración intravenosa y oral), triazolam, trimetoprima / sulfametoxazol o zidovudina tiene poco efecto. Cuando se usan juntos, efavirenz o fluconazol tienen poco efecto sobre la farmacocinética de azitromicina. Cuando la azitromicina se combina con cualquiera de los medicamentos anteriores, no es necesario ajustar la dosis de ninguno de los medicamentos.
No se ha informado que la azitromicina interactúe con los siguientes medicamentos en ensayos clínicos. Sin embargo, hasta la fecha no se han realizado estudios específicos para evaluar la interacción potencial entre azitromicina y estos medicamentos. Sin embargo, estas condiciones han ocurrido cuando se usaron otros macrólidos. Por lo tanto, en ausencia de nuevos datos de investigación, la azitromicina debe observarse de cerca cuando se combina con los siguientes medicamentos:
La concentración sanguínea de digoxina-digoxigenina aumentó.
Ergosamina o dihidroergotamina: intoxicación aguda por ergot, que se manifiesta como vasoespasmo periférico severo y disestesia.
La terbinadina, la ciclosporina, la hestobeta y la fenitoína se elevaron en concentración.
Impacto en las pruebas de laboratorio: No se han reportado informes de efectos en las pruebas de laboratorio.
[Sobredosis de drogas] Los efectos adversos de la sobredosis de drogas son los mismos que la dosis recomendada. Una vez que se produce el uso excesivo, se puede brindar atención sintomática y de apoyo según la afección, como lavado gástrico o terapia de apoyo general.
【Farmacología y Toxicología】
Acción farmacológica
La azitromicina es un antibiótico azalida cuyo mecanismo de acción es interferir con la síntesis de su proteína (sin afectar la síntesis de ácidos nucleicos) al unirse a la subunidad del ribosoma 50 de microorganismos sensibles.
Estudios in vitro y clínicos han demostrado que la azitromicina tiene un efecto antibacteriano en una variedad de bacterias patógenas:
Microorganismos aerobios grampositivos: Staphylococcus aureus, Streptococcus pyogenes, Streptococcus pneumoniae, Streptococcus hemolyticus.
La azitromicina es resistente a las bacterias grampositivas resistentes a la eritromicina. La mayoría de Streptococcus faecalis (Enterococcus) y Staphylococcus resistente a la meticilina son resistentes a este producto.
Microorganismos aerobios gramnegativos: Haemophilus influenzae, Moraxella catarrhalis, Mycoplasma trachomatis.
Los estudios in vitro y clínicos han confirmado que la azitromicina puede prevenir enfermedades causadas por el complejo intracelular de Mycobacterium (compuesto por Mycobacterium avium y Mycobacterium intracellulare).
La azitromicina es ineficaz contra las cepas que producen beta-lactamasa.
Los estudios han demostrado que la azitromicina tiene un efecto antibacteriano in vitro en los siguientes microorganismos, pero su importancia clínica aún no está clara, incluidos Streptococcus (C, F, G), Streptococcus mutans, Bordetella pertussis, Haemophilus ducrei, Legionella pneumophila , Bacteroides, Streptococcus pneumoniae, Borrelia, Chlamydia pneumoniae, Treponema pallidum, Ureaplasma urealyticum y similares.
Investigación toxicológica
Resultados de genotoxicidad del ensayo de linfocitos humanos, el ensayo de micronúcleos de médula ósea de ratón y el ensayo de células de linfoma in vitro de ratón La azitromicina no mostró efectos mutagénicos.
Toxicidad para la reproducción Las pruebas de toxicidad para la reproducción en ratas y ratones han demostrado que cuando las dosis de azitromicina (administración oral) alcanzan un nivel de dosis que produce una toxicidad materna moderada (es decir, 200 mg / kg / día, aproximadamente 500 mg de dosis humana en función de la superficie corporal) No se observó ningún efecto teratogénico cuando / kg / día fue de 2 a 4 veces.
No se han encontrado daños a la fertilidad y al feto. Actualmente no hay ensayos clínicos controlados adecuados y rigurosos en mujeres embarazadas. Dado que los resultados de los estudios de reproducción animal no siempre predicen las condiciones humanas, la azitromicina solo puede ser utilizada por mujeres embarazadas cuando es realmente necesario. No se sabe si este producto se secreta en la leche humana, ya que muchos medicamentos son secretados por la leche humana, las mujeres que están amamantando deben prestarle atención cuando lo usan.
Carcinogenicidad No hay estudios sobre la carcinogenicidad del uso a largo plazo de animales con azitromicina.
[Farmacocinética]
Se absorbe rápidamente después de la administración oral y tiene una biodisponibilidad del 37%. Después de una dosis única de 0.5 g por vía oral, el tiempo pico es de 2.5 a 2.6 horas, y la concentración plasmática máxima (Cmáx) es de 0.4 a 0.45 mg / L. Este producto está ampliamente distribuido en el cuerpo, la concentración en cada tejido puede alcanzar 50 veces la concentración sanguínea en el mismo período, y la concentración en macrófagos y fibroblastos es alta, la primera puede transportar azitromicina al sitio de inflamación. La vida media de eliminación de sangre (T1 / 2) después de la administración de un solo agente es de 35 a 48 horas, y más del 50% de la cantidad administrada se descarga a través del tracto biliar en la forma original, y aproximadamente el 4.5% en la forma original se descarga a través de la orina dentro de las 72 horas posteriores a la administración. La tasa de unión a proteínas séricas de este producto se reduce con el aumento de la concentración en sangre. Cuando la concentración en sangre es 0.02μg / ml, la tasa de unión a proteínas séricas es 15%. Cuando la concentración en sangre es 2μg / ml, la tasa de unión a proteínas séricas es 7% Los alimentos no afectan la biodisponibilidad de este producto.
[Almacenamiento] sombreado, sellado y almacenamiento en un lugar seco.
[Embalaje] embalaje de plástico de aluminio, 6 piezas / caja, 12 piezas / caja.
[Período de validez] 24 meses.
[Normas ejecutivas] La segunda edición de la edición 2010 de la Farmacopea China.
[Aprobación No.] Norma Nacional de Drogas H20020729.
[Fabricante]
Nombre de la empresa: Lunan Beite Pharmaceutical Co., Ltd.
Dirección de producción: No. 243, Yinqueshan Road, ciudad de Linyi, provincia de Shandong
Código postal: 276006
Número de teléfono: 0539-8336336 (Ventas) 0539-8336337 (Departamento de tuberías de calidad)
Número de fax: 0539-8336029 (Ventas) 0539-8336338 (Departamento de tuberías de calidad)
Sitio web: www.LUNAN.com.cn
Línea directa de atención al cliente las 24 horas: 400-0539-310
